
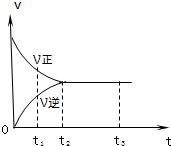
| A.0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B.t2~t3时,反应体系中Y2的浓度没有变化 |
| C.到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D.从关系曲线可知,反应开始时体系中只有X2和Y2 |
科目:高中化学 来源:不详 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.降低温度和增大压强 | B.降低温度和减小压强 |
| C.升高温度和减小压强 | D.升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b |
| B.若a=b,则容器中一定使用了催化剂 |
| C.若保持温度、压强不变,充入惰性气体,则有a<b |
| D.若其他条件不变,升高温度,则有a<b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3?Ca2++CO32- | B.H2CO3?2H++CO32- |
| C.NH3?H2O?NH3+H2O | D.H2SO3?H++HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com