
| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
分析 A.在水溶液或者熔融状态能够导电的化合物属于电解质;
B.能和碱反应生成盐和水的氧化物属于酸性氧化物;
C.依据硫化氢中各元素的化合价判断;
D.H2S、NO和CO都具有强的还原性,臭氧具有强的氧化性.
解答 解:A.硫化氢在水溶液中能够电离产生自由移动的离子而导电,属于电解质,故A错误;
B.NO和CO不能与碱反应,不属于酸性氧化物,故B错误;
C.H2S中H显+1价化合价可以降低,S显-2价化合价可以升高,所以既有还原性又有氧化性,故C错误;
D.H2S、NO和CO都具有强的还原性,臭氧具有强的氧化性,H2S、NO和CO都能被臭氧氧化,故D正确;
故选:D.
点评 本题考查了硫化氢的性质,熟悉电解质、非电解质、酸性氧化物的概念,明确氧化还原反应的规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | x(O2) | 与O2反应的 (Q1/kJ) | 与H2O反应的 (Q2/kJ) | 总反应的 (Q3/kJ) |
| I | 0.2 | -18 | ||
| Ⅱ | -36 | +72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | K+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
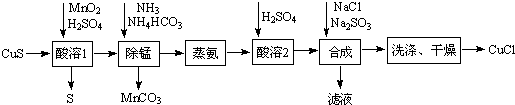
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com