
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2017届安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:推断题
已知:①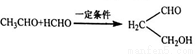 ②
②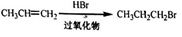
现用丙二酸等物质合成含有小环的有机物K,合成路线如下:
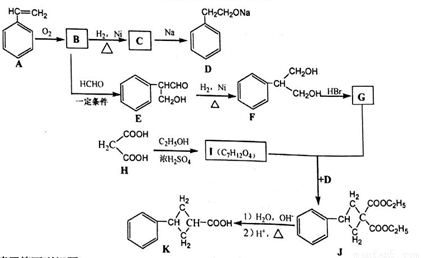
请回答下列问题:
(1)A的名称是_______,E中含氧官能团的名称是_____。
(2)B→C 的反应类型是_______ ,F→G的反应类型是____。
(3)G和I的结构简式分别为_______、________。
(4)写出F和H在一定条件下合成高分子化合物的化学反应方程式:_______。
(5)同时满足下列条件的E的同分异构体数目为________种。
① 能发生银镜反应;② 能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应。
(6)请写出以H2C=CHCH2Br为原料制备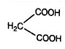 ,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
下列实验方法能达到实验目的的是
A. 用丁达尔现象区分氢氧化铁胶体与氯化铜溶液
B. 用淀粉溶液检验食盐溶液中是否存在IO3-
C. 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液
D. 进入煤矿矿井时用火把照明
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用的说法中,均正确的是
A. Fe3+具有氧化性,可溶解印刷电路板上的金属铜
B. 碳酸钡、硫酸钡均难溶于水,均可用作钡餐
C. 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚
D. 二氧化硅具有半导体性能,可以制成光电池
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
14C可用于考古,“14”是指
A. 质量数 B. 核外电子数 C. 中子数 D. 质子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:填空题
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
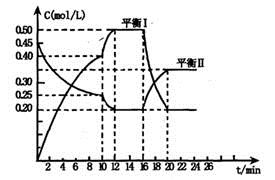
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
室温时,下列溶液混合后,pH大于7的是
A. 0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B. 0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C. pH=3的硫酸和pH=11的氨水等体积混合
D. pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三第四次月考化学试卷(解析版) 题型:简答题
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:
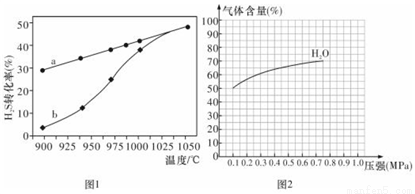
(1)方法一:H2S热分解法,反应式为:H2S (g)  H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H___________0(填“>”“<”或“=”)。
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:_________________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s) + H2O (g) = CO (g) + H2(g) △H = + 131.6 kJ/mol
II.CO (g) + H2O (g) = CO2 (g) + H2 (g) △H = -43 kJ/mol
III.CaO(s) + CO2(g) = CaCO3(s) △H = -178.3 kJ/mol
①计算反应C (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)的△H=_____(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=______(用K1、K2、K3表示)。
②对于可逆反应C (s) +2H2O(g) +CaO(s)  CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
A.适当的降低体系的温度 B.使各气体组分浓度均加倍
C.用特殊材料吸收氢气 D.增加CaO的量
③图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O)=2c(H2)= 2c(CO)=2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。___________________
(3)以N2、H2为电极反应物,以HCl-NH4C1为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com