
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为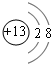 .
.分析 X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,结合原子序数大小可知Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素,据此进行解答.
解答 解:X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素.
(1)碳元素的最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为 ,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为:
,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为: ,
,
故答案为: ;
; ;
;
(2)单质碳和浓硝酸反应生成二氧化氮、二氧化碳与水,反应的化学方程式为:4 HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2+2H2O,
NH3分子间存在氢键,故氨气的沸点高于PH3的,
故答案为:4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2+2H2O;NH3;NH3分子间存在氢键;
(3)元素W为P,最外层电子数为5,位于周期表的第VA族;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱,
故答案为:第三周期第 VA;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱;
(4)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,侧重对化学用语的考查,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 氯化镁溶液与过量的氨水反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 稀硫酸与过量的铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 将苯与浓硝酸和浓硫酸的混合酸共热至50℃~60℃制硝基苯 | |
| C. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| D. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同分异构体 | |
| B. | 石墨转化为金刚石没有破坏化学键属于物理变化 | |
| C. | 等质量的石墨与金刚石完全燃烧,放出的能量相同 | |
| D. | 金刚石不如石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 用米汤检验含碘盐中的碘酸钾(KIO3) | |
| C. | 用食用碱(Na2CO3)溶液洗涤餐具上的油污 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com