
| A. | 在整个化学反应过程中有2Q1+Q2═2Q | |
| B. | 根据能量守恒有Q1+Q2═Q | |
| C. | 由水蒸气分解为氢气和氧气的△H=(Q-Q1-Q2) kJ | |
| D. | 形成1 mol H-O键放出的能量为 kJ |
分析 氢气在氧气中燃烧生成水蒸气是一个放热反应,且反应生成1mol H2O(g)时放出的热量为Q kJ,故可以写出热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-QKJ/mol.而△H=断键消耗的能量-成键放出的能量,据此分析.
解答 解:氢气在氧气中燃烧生成水蒸气是一个放热反应,且反应生成1mol H2O(g)时放出的热量为Q kJ,故可以写出热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-QKJ/mol.
A、由于反应热△H=断键消耗的能量-成键放出的能量,故有:△H=-Q=Q1+$\frac{1}{2}$Q2-形成水中的H-O键所放出的能量,故A错误;
B、根据能量守恒应该有:1mol氢气能量+0.5mol氧气的能量=1mol水蒸气的能量+Q,故B错误;
C、由于氢气在氧气中燃烧生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-QKJ/mol,故可知:1mol水蒸气分解为1mol氢气和0.5mol氧气时吸收QKJ能量,即H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+QKJ/mol,故C错误;
D、设形成1molH-O键放出的能量为XKJ,由于反应热△H=断键消耗的能量-成键放出的能量,故有:△H=-Q=Q1+$\frac{1}{2}$Q2-2X,故有X=$\frac{Q+{Q}_{1}+\frac{1}{2}{Q}_{2}}{2}$,故D正确.
故选D.
点评 本题考查了根据断键吸收的能量和成键所放出的能量来计算反应热,难度不大,应注意的是反应热△H=断键消耗的能量-成键放出的能量.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅具有半导体的性质,所以可以制作光导纤维 | |
| B. | 氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应 | |
| C. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| D. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4) | B. | (1)(2)(3)(4)(5) | C. | (1)(2)(4) | D. | (1)(2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 1 mol Al3+含有核外电子数为10NA | |
| D. | 1 L 1 mol/L FeCl3溶液中Cl-的数目等于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1mol Cl2含有2NA个氯原子 | |
| C. | 摩尔既可表示质量,又可以表示数量 | |
| D. | 32g O2所含O2的摩尔数是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
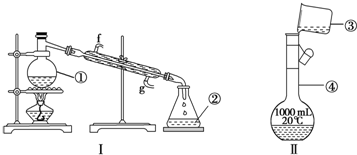
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
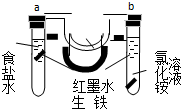 如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )
如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )| A. | a中发生了吸氧腐蚀,b中发生了析氢腐蚀 | |
| B. | 两试管中负极反应均是:Fe-2e-=Fe2+ | |
| C. | 生铁块中碳作原电池正极 | |
| D. | 红墨水在一段时间后,两边液面变为左低右高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com