

| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.
已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
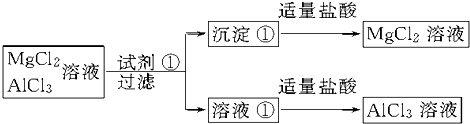
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| VA |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| B | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯、苯、溴苯分子中的所有原子均共平面 |
| B、水加热至1000℃以上才分解是因为水分子间存在着氢键 |
| C、常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸 |
| D、能发生银镜反应的有机物结构中一定含有-CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com