
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ | |
| D. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
分析 A.根据分散质粒子直径大小将分散系分为悬浊液、胶体、溶液,分散质粒子直径大于100nm的为悬浊液,分散质粒子直径在1-100nm之间的为胶体,分散质粒子直径小于1nm的为溶液;
B.焰色反应属于物理变化;
C.钢铁发生电化学腐蚀时,Fe作负极,失电子生成亚铁离子;
D.电解精炼粗铜时,阳极泥中含有不如Cu活泼的金属.
解答 解:A.根据分散质粒子直径大小将分散系分为悬浊液、胶体、溶液,分散质粒子直径大于100nm的为悬浊液,分散质粒子直径在1-100nm之间的为胶体,分散质粒子直径小于1nm的为溶液,所以分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故A正确;
B.焰色反应是金属元素的特性,是金属元素的物理性质,没有发生化学变化,故B错误;
C.钢铁发生电化学腐蚀时,Fe作负极,失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故C错误;
D.电解精炼粗铜时,阳极泥中含有不如Cu活泼的金属,所以阳极泥中含有Ag、Au等金属,不含Zn、Fe,故D错误;
故选A.
点评 本题考查较综合,涉及分散系、焰色反应、原电池原理、电解精炼等知识点,明确反应原理、物质性质是解本题关键,易错选项是CD,注意阳极泥的形成原理,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:解答题
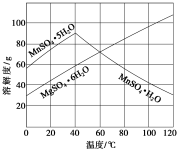 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
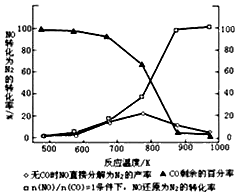 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| C. | 电解精炼铜时,若转移了NA个电子,则阳极质量减小32g | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
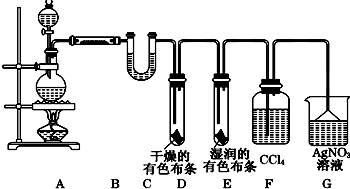
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com