
| A、CO2的结构式:O-C-0 |
B、氟化钠的电子式: |
C、CCl4分子的比例模型: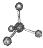 |
D、金刚石的结构模型: |
 故C错误;
故C错误;


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
 常温下有0.1mol?L-1五种溶液NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol?L-1五种溶液NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B、加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C、等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中c(K+)=c(H2X)+c(HX-)+c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与稀硝酸反应:Cu+2H+=Cu2++H2↑ |
| B、铁粉和氯化铁溶液混合:Fe+2Fe3+=3Fe2+ |
| C、氯化铝溶液和氨水混合:Al+3OH-=Al(OH)3↓ |
| D、钾溶于水:K+H2O=K++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液使酚酞试液变红:S2-+2H2O═2OH-+H2S |
| B、在醋酸溶液中加入Na2CO3溶液:CO32-+2H+=CO2↑+H2O |
| C、NH4HCO3溶液与过量NaOH溶液混合:NH4++OH-=NH3?H2O |
| D、用小苏打治疗胃酸(含盐酸)过多:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧气通入正极发生氧化反应 |
| B、燃料电池的能量转化率不能达到100% |
| C、供电时的总反应为:2H2+O2=2H2O |
| D、产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤④③ |
| B、①④③②⑤ |
| C、⑤②①④③ |
| D、②①⑤④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.
在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.| ①V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com