乙醛能与银氨溶液反应析出银.如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应.银镜的光亮程度与反应条件有关.某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究.
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是
.
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11
时,出现银镜的时间范围是
.
(3)进一步实验还可探索
对出现银镜快慢的影响.
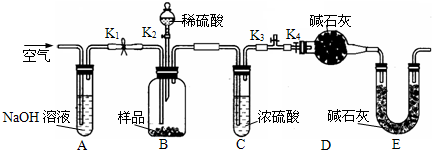
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环
境,且造成银资源的浪费.通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
Ag
2S沉淀
银粉
4)操作④的方法是把Ag
2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag
2S变成银粉,反应的化学方程式为
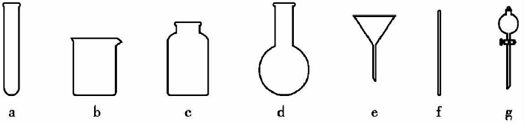
.过滤需要用到的玻璃仪器有
(填编号).
(5)操作④应在
(填实验室设备名称)中进行.
(6)要洗去试管壁上的银镜,采用的试剂是
(填名称).




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案