
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤___(选填①、②、③、⑤)。
(3)滤渣2的主要成分为___。
(4)写出步骤④后产生滤渣3的离子反应方程式___。
Ⅱ.BaS溶液的制备:

(5)写出煅烧还原的化学反应方程式____。
Ⅲ.制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
【答案】2Fe2++2H++H2O2=2Fe3++2H2O ① Fe(OH)3、Cu(OH)2 ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3- BaSO4+4C![]() BaS+4CO↑ 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
BaS+4CO↑ 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
【解析】
I、ZnSO4的制备流程:菱锌矿用硫酸溶解后,得到的滤渣1为SiO2,溶液中的阳离子有Zn2+、Fe2+、Cu2+,加入H2O2的目的是将Fe2+转化为Fe3+,再加入过量的NaOH,Fe3+和Cu2+形成滤渣2,而Zn2+转化为ZnO22-,留在溶液中;向所得溶液通入CO2,Na2ZnO2转化为Zn(OH)2形成滤渣3,再用硫酸溶解Zn(OH)2即得ZnSO4;
II、根据题中的反应物和生成物写出反应方程式即可;
III、BaS和过量的酸反应生成的H2S会污染环境,同时也锌钡白的产率也会降低。
(1)加入氧化剂二价铁被氧化为三价铁,若②中加入氧化剂为H2O2,反应的离子方程式为2Fe2+ +2H++H2O2 =2Fe3++2H2O;
(2)因步骤①中,硫酸与ZnCO3、FeCO3、Cu2(OH)2CO3反应时均产生CO2,为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤①;
(3)根据上述分析,滤渣2的主要成分为Fe(OH)3、Cu(OH)2;
(4)由题目信息知:Zn(OH)2与Al(OH)3相似,则与Na2ZnO2与NaAlO2类似,即Na2ZnO2与过量CO2反应方程式为:Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3,离子方程式为;ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(5)根据示意图,硫酸钡与碳粉煅烧还原反应生成BaS和CO,反应的化学反应方程式为BaSO4+4C![]() BaS+4CO↑;
BaS+4CO↑;
(6)如果Ⅰ中步骤⑤使用硫酸过量,会发生如下反应,BaS+H2SO4=H2S↑+ZnSO4,H2S气体有毒,会污染环境,而且锌钡白的产率会降低。


科目:高中化学 来源: 题型:
【题目】盐X由三种元素组成,其具有良好的热电性能,在热电转换领域具有广阔的应用前景。为研究它的组成和性质,现取12.30g化合物X进行如下实验:

试根据以上内容回答下列问题:
(1)X的化学式为_____________。
(2)无色溶液B中通入过量CO2产生白色沉淀的离子方程式为______________。
(3)蓝色溶液F中通入中SO2气体会产生白色沉淀,该沉淀中氯元素质量分数为35.7%,其离子方程式为____________。
(4)白色沉淀C煅烧的固体产物与D高温反应可生成化合物X,其化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ·mol1;
2CO2(g) ΔH=566 kJ·mol1;
Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ·mol1
O2(g) ΔH=226 kJ·mol1

根据以上热化学方程式和图像判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>452 kJ·mol1
C. 上图可表示由1 mol CO生成CO2的反应过程和能量关系
D. 根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与浓硫酸共热制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2 。

(1)装置中X仪器的名称是____;碎瓷片的作用是____;
(2)写出生成乙烯的反应方程式____;
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号)
①NaOH溶液,②品红溶液,③KMnO4酸性溶液,④FeCl3溶液
A.___ B.___ C.___ D.___
(4)能说明SO2气体存在的现象是_______________;
(5)确证含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.SO2易溶于水只是因为相似相溶原理
B.乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C.H3PO4分子中P原子采取sp3杂化
D.由图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
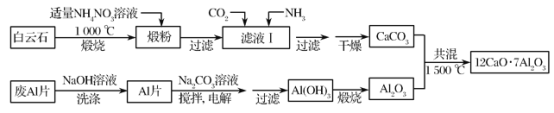
(1)煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则滤液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是______________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com