
ЎҫМвДҝЎҝДі№Өі§өД°ұөӘ·ПЛ®ЦРЦчТӘә¬УР![]() Ј¬ҝЙУГөз»ҜС§Сх»Ҝ·ЁјУТФҙҰАнЎЈ
Ј¬ҝЙУГөз»ҜС§Сх»Ҝ·ЁјУТФҙҰАнЎЈ
ЈЁ1Ј©Нј1КЗөз»ҜС§Сх»Ҝ·ЁөДФӯАнКҫТвНјЎЈaөДөзј«·ҙУҰКҪКЗ_____________ЎЈ
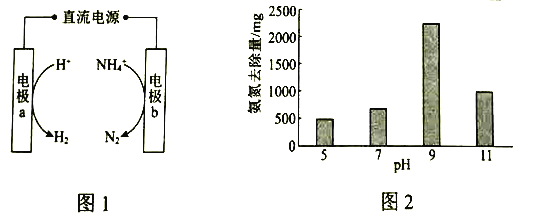
ЈЁ2Ј©СРҫҝПФКҫЈ¬ЖдЛыМхјюІ»ұдКұЈ¬І»Н¬![]() ПВ°ұөӘөДИҘіэБҝИзНј2ЛщКҫЎЈТСЦӘЈә
ПВ°ұөӘөДИҘіэБҝИзНј2ЛщКҫЎЈТСЦӘЈә![]() Ул
Ул![]() ПаұИЈ¬ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЎЈҪбәПЖҪәвТЖ¶ҜФӯАнәННјЦРКэҫЭЈ¬ҪвКН
ПаұИЈ¬ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЎЈҪбәПЖҪәвТЖ¶ҜФӯАнәННјЦРКэҫЭЈ¬ҪвКН![]() ҙУ5өҪ9Кұ°ұөӘИҘіэБҝФцҙуөДФӯТтЈә______________ЎЈ
ҙУ5өҪ9Кұ°ұөӘИҘіэБҝФцҙуөДФӯТтЈә______________ЎЈ
ЈЁ3Ј©ФЪөзҪв·ПЛ®өД№эіМЦРЈ¬![]() »бҫӯАъЎ°
»бҫӯАъЎ°![]() ЎұөД№эіМЎЈЖдЛыМхјюПаН¬Ўў
ЎұөД№эіМЎЈЖдЛыМхјюПаН¬Ўў![]() өДЕЁ¶ИІ»Н¬КұЈ¬·ПЛ®ЦР°ұөӘНСіэР§ВКөДКөСйҪб№ыИзПВЈә
өДЕЁ¶ИІ»Н¬КұЈ¬·ПЛ®ЦР°ұөӘНСіэР§ВКөДКөСйҪб№ыИзПВЈә
| 400 | 100 |
өзҪвКұјд/h | 0.5 | 0.5 |
°ұөӘНСіэР§ВК/ЈЁ | 2.40.8 |
ўЩЖдЛьМхјюПаН¬ЎўККөұМбёЯ![]() өДЕЁ¶ИЈ¬ҝЙТФПФЦшФцҙу·ПЛ®ЦР
өДЕЁ¶ИЈ¬ҝЙТФПФЦшФцҙу·ПЛ®ЦР![]() өДНСіэР§ВКЎЈ
өДНСіэР§ВКЎЈ
УГ»ҜС§УГУпҪвКНФӯТтЈә____________Ўў![]() ЎЈ
ЎЈ
ўЪНј2ЦРЈ¬![]() КұЈ¬·ПЛ®ЦР
КұЈ¬·ПЛ®ЦР![]() ИҘіэБҝПВҪөЈ¬ҝЙДЬөДФӯТтКЗЈә_______________ЎЈ
ИҘіэБҝПВҪөЈ¬ҝЙДЬөДФӯТтКЗЈә_______________ЎЈ
Ўҫҙр°ёЎҝ![]() ·ПЛ®ЦРҙжФЪЈә
·ПЛ®ЦРҙжФЪЈә![]() Ј¬
Ј¬![]() ФцҙуЈ¬
ФцҙуЈ¬![]() ҪөөНЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬
ҪөөНЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬![]() ФцҙуЈ¬УРАыУЪә¬өӘОўБЈФЪөзј«ұнГжОьёҪ
ФцҙуЈ¬УРАыУЪә¬өӘОўБЈФЪөзј«ұнГжОьёҪ ![]()
![]() ҪПҙуЈ¬УЕПИ·ЕөзЈЁ»т
ҪПҙуЈ¬УЕПИ·ЕөзЈЁ»т![]() Ул
Ул![]() ҪбәПЙъіЙ
ҪбәПЙъіЙ![]() Ј¬
Ј¬![]() ТЭіцЈ»»т
ТЭіцЈ»»т![]() Ул
Ул![]() »бЙъіЙ
»бЙъіЙ![]() Ј¬јоРФМхјюПВ
Ј¬јоРФМхјюПВ![]() Сх»ҜРФИхЈ©ЎЈ
Сх»ҜРФИхЈ©ЎЈ
ЎҫҪвОцЎҝ
ЈЁ1Ј©ёГЧ°ЦГОӘөзҪвіШЈ¬aөзј«КЗ![]()
![]() Ј¬»ҜәПјЫҪөөНЈ¬өГөзЧУЧчОӘТхј«Ј»
Ј¬»ҜәПјЫҪөөНЈ¬өГөзЧУЧчОӘТхј«Ј»
ЈЁ2Ј©ТСЦӘЈә![]() Ул
Ул![]() ПаұИЈ¬ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЎЈ
ПаұИЈ¬ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЎЈ![]() ФцҙуЈ¬
ФцҙуЈ¬![]() Л®ҪвІъЙъөД
Л®ҪвІъЙъөД![]() ФҪ¶аЈ¬°ұөӘИҘіэБҝФцҙуЈ»
ФҪ¶аЈ¬°ұөӘИҘіэБҝФцҙуЈ»
ЈЁ3Ј©өзҪв·ПЛ®өД№эіМЦРЈ¬![]() ПИФЪСфј«К§өзЧУІъЙъ
ПИФЪСфј«К§өзЧУІъЙъ![]() Ј¬ФЩУЙ
Ј¬ФЩУЙ![]() Сх»Ҝ
Сх»Ҝ![]() Ј»
Ј»
ЈЁspan>4Ј©ҝЙҙУВИЖшЕЁ¶ИјхРЎЎў![]() ТЭіцөИ·ҪГжИлКЦЈ»
ТЭіцөИ·ҪГжИлКЦЈ»
ЈЁ1Ј©УЙ·ЦОцҝЙЦӘЈ¬Тхј«aөДөзј«·ҙУҰКҪКЗ![]() ЎЈ
ЎЈ
ЈЁ2Ј©ҪбәП·ЦОцәНМвёЙҝЙЦӘЈ¬·ПЛ®ЦРҙжФЪЈә![]() Ј¬ИЬТә
Ј¬ИЬТә![]() ФцҙуЈ¬
ФцҙуЈ¬![]() »бҪөөНЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬
»бҪөөНЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬![]() ФцҙуЈ¬
ФцҙуЈ¬![]() ұИ
ұИ![]() ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЈ¬УРАыУЪә¬өӘОўБЈФЪөзј«ұнГжОьёҪЈ»
ФЪөзј«ұнГжөДОьёҪР§№ыёьәГЈ¬УРАыУЪә¬өӘОўБЈФЪөзј«ұнГжОьёҪЈ»
ЈЁ3Ј©ўЩөзҪв·ПЛ®өД№эіМЦРЈ¬![]() ПИФЪСфј«К§өзЧУІъЙъ
ПИФЪСфј«К§өзЧУІъЙъ![]() Ј¬өзј«·ҙУҰКҪОӘЈә
Ј¬өзј«·ҙУҰКҪОӘЈә![]() Ј»
Ј»
ўЪҪбәПўЩОКЈ¬![]() КұЈ¬·ПЛ®ЦР
КұЈ¬·ПЛ®ЦР![]() ИҘіэБҝПВҪөЈ¬ҝЙДЬөДФӯТтКЗВИЖшЕЁ¶ИјхРЎЈЁИзЈә
ИҘіэБҝПВҪөЈ¬ҝЙДЬөДФӯТтКЗВИЖшЕЁ¶ИјхРЎЈЁИзЈә![]() ҪПҙуЈ¬УЕПИ·ЕөзЈ»
ҪПҙуЈ¬УЕПИ·ЕөзЈ»![]() Ул
Ул![]() »бЙъіЙ
»бЙъіЙ![]() Ј¬јоРФМхјюПВ
Ј¬јоРФМхјюПВ![]() Сх»ҜРФИхЈ©Ўў
Сх»ҜРФИхЈ©Ўў![]() ТЭіцЈЁ
ТЭіцЈЁ![]() Ул
Ул![]() ҪбәПЙъіЙ
ҪбәПЙъіЙ![]() Ј¬
Ј¬![]() ТЭіцЈ©өИЎЈ
ТЭіцЈ©өИЎЈ


 ГыРЈҝОМГПөБРҙр°ё
ГыРЈҝОМГПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіэИҘҙЦСОЦРөДФУЦК CaCl2ЎўMgCl2 әН Na2SO4,№эіМИзПВЈә
![]()
ПВБРУР№ШЛө·ЁЦРЈ¬І»ХэИ·өДКЗ( )
A. іэИҘ Mg2+өДЦчТӘ·ҙУҰЈә Mg2++ 2OH-=Mg(OH)2Ўэ
B. КФјБўЩТ»¶ЁІ»КЗNa2CO3ИЬТә
C. јмСй SO42-КЗ·сіэҫ»ЈәИЎЙЩБҝВЛТәЈ¬јУПЎСОЛбЛб»ҜЈ¬ФЩјУ BaCl2 ИЬТә
D. ВЛТәјУПЎСОЛбКұЦ»·ўЙъ·ҙУҰЈәH+ +OH- =H2O
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝK2FeO4КЗТ»ЦЦјҜСх»ҜЎўОьёҪЎўРхДэЎўПы¶ҫЎўЙұҫъЎўіэіфөИ№ҰДЬУЪТ»МеөДВМЙ«ёЯР§Л®ҙҰАнјБЈ¬ТСіЙОӘ¶аёцБмУтІ»ҝЙ¶МИұөДОпЦКЦ®Т»Ј¬№ӨТөЦЖұё№ӨТХИзНјЛщКҫЈ¬»ШҙрПВБРОКМвЈә

ЈЁ1Ј©ФЪКӘ·ЁЦЖұёNa2FeO4№ӨТХЦРЈ¬ЗлРҙіцВИјо№ӨТө№эіМЦРУГ¶иРФөзј«өзҪвұҘәНNaClИЬТәөДАлЧУ·ҪіМКҪЈә___Ј»NaClOУлFeCl3ФЪјоРФМхјюПВЦЖұёNa2FeO4өД·ҙУҰЦРұ»Сх»ҜөДФӯЧУУлұ»»№ФӯөДФӯЧУёцКэұИОӘ____Ј»ҝЙСӯ»·К№УГөДОпЦКОӘ___ЈЁИОРҙТ»ЦЦЈ©ЎЈ
ЈЁ2Ј©өзҪв·ЁЦЖұёNa2FeO4№ӨТХЦРЈ¬Сфј«ІДБПОӘМъЖҪ°еЈ¬ФЪК№УГЗ°ТӘҫӯ№эҙЦЙ°әНПёЙ°ҙтДҘЕЧ№вЈ¬ЖдДҝөДОӘ____Ј»оСәПҪрІДБПЧчТхј«Ј¬өзҪвЦКИЬТәОӘNaOHИЬТәЈ¬ЗлРҙіцСфј«өзј«·ҙУҰКҪЈә____ЎЈ
ЈЁ3Ј©ёЙ·ЁЦЖұёNa2FeO4№ӨТХКЗЧоФз·ўПЦөДЦЖұё№ӨТХЈ¬ЗлРҙіцNaClO№ММеЎўFe(NO3)3ЎӨ9H2Oҫ§МеЎўNaOH№ММеФЪёЯОВИЫИЪөДМхјюПВЦЖұёNa2FeO4өД»ҜС§·ҪіМКҪЈә_____ЎЈ
ЈЁ4Ј©ЗлРҙіцУЙNa2FeO4ЦЖұёK2FeO4өД»ҜС§·ҪіМКҪЈә____Ј»ЗлЛөГчёГ·ҙУҰДЬ·ўЙъөДФӯТтЈә____ЎЈ
ЈЁ5Ј©ҙЦK2FeO4МбҙҝКұУГ-5ЎжұҘәНKOHөДФӯТт____Ј»K2FeO4КЗВМЙ«Л®ҙҰАнјБЈ¬ДЬ¶ФЛ®ЖрөҪЙұҫъЎўПы¶ҫЈ¬УЦДЬЖрөҪҫ»Л®өДЧчУГЈ¬ЖдФӯТтОӘ_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗ
A.ұкҝцПВЈ¬11.2 LјЧНйЈЁCH4Ј©әНТТП©ЈЁC2H4Ј©өД»мәПЖшМеЦРә¬ЗвФӯЧУөДОпЦКөДБҝОӘ2 mol
B.ұкҝцПВЈ¬0.1 mol CCl4ЛщХјөДМе»эОӘ2.24 L
C.өИЦКБҝөДN2әНCOә¬УРөД·ЦЧУКэҫщФјОӘ6.02ЎБ1023ёц
D.іЈОВіЈС№ПВЈ¬1 molИОәОЖшМеЛщХјөДМе»эҫщОӘ22.4 L
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөзЙшОц·Ёөӯ»ҜәЈЛ®өДФӯАнИзНјЛщКҫЎЈТСЦӘәЈЛ®ЦРә¬![]() өИАлЧУЈ¬өзј«ОӘ¶иРФөзј«ЎЈПВБРРрКцХэИ·өДКЗ
өИАлЧУЈ¬өзј«ОӘ¶иРФөзј«ЎЈПВБРРрКцХэИ·өДКЗ
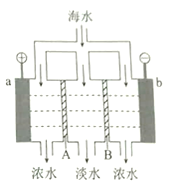
A. AКЗСфАлЧУҪ»»»ДӨ
B. әЈЛ®ЦРТхАлЧУТЖПтbөзј«
C. aөДөзј«·ҙУҰОӘ![]()
D. bј«ІъЙъОЮЙ«ЖшМеЈ¬іцПЦ°ЧЙ«іБөн
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЖЯВБК®¶юёЖЈЁ12CaO7Al2O3Ј©КЗРВРНөДі¬өјІДБПәН·ў№вІДБПЈ¬УГ°ЧФЖКҜЈЁЦчТӘә¬CaCO3әНMgCO3Ј©әН·ПAlЖ¬ЦЖұёЖЯВБК®¶юёЖөД№ӨТХИзПВЈә
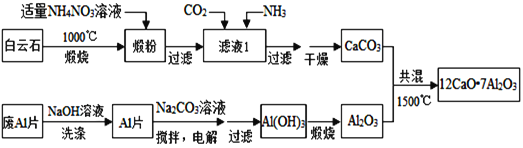
ЈЁ1Ј©¶Н·ЫЦчТӘә¬______әН______Ј¬УГККБҝNH4NO3ИЬТәҪюИЎмС·ЫәуЈ¬Гҫ»ҜәПОпјёәхІ»ИЬЎЈёГ№ӨТХЦРІ»ДЬУГЈЁNH4Ј©2SO4ҙъМжNH4NO3Ј¬ФӯТтКЗ_______________________________________________Ј®
ЈЁ2Ј©ВЛТәўсЦРТхАлЧУУР______ЈЁәцВФФУЦКіЙ·ЦөДУ°ПмЈ©Ј»ИфВЛТәўсЦРҪцНЁИлCO2Ј¬»бЙъіЙ______Ј¬ҙУ¶шөјЦВCaCO3ІъВКҪөөНЈ®
ЈЁ3Ј©УГNaOHИЬТәҝЙіэИҘ·ПAlЖ¬ұнГжөДСх»ҜДӨЈ¬·ҙУҰөДАлЧУ·ҪіМКҪОӘ______________________Ј®
ЈЁ4Ј©өзҪвЦЖұёAlЈЁOHЈ©3КұЈ¬өзј«·ЦұрОӘAlЖ¬әНКҜД«Ј¬ФтВБЖ¬ҪУНвөзФҙөД____ј«Ј¬өзҪвКұТхј«·ўЙъөД·ҙУҰОӘЈә______Ј®
ЈЁ5Ј©Т»ЦЦҝЙі¬ҝмідөзөДРВРНВБөзіШЈ¬ід·ЕөзКұAlCl4©ҒәНAl2Cl7©ҒБҪЦЦАлЧУФЪAlөзј«ЙППа»ҘЧӘ»ҜЈ¬ЖдЛьАлЧУІ»ІОУлөзј«·ҙУҰЈ¬·ЕөзКұёәј«AlөДөзј«·ҙУҰКҪОӘ______________________________________Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТАҫЭЛщёшМхјюНЖіцөДҪбВЫІ»ХэИ·өДКЗЈЁ Ј©
СЎПо | Мхјю | ҪбВЫ |
A | ФЪЛ®ИЬТә»тИЫИЪЧҙМ¬ПВҝЙТФөјөзөД»ҜәПОпЈ¬іЖОӘөзҪвЦК | Л®ЦРҙжФЪЈә |
B | ·ІКЗДЬёшіцЦКЧУөД·ЦЧУ»тАлЧУіЖОӘЛбЈ¬·ІКЗДЬҪУКЬЦКЧУөД·ЦЧУ»тАлЧУіЖОӘјо |
|
C | БӘ°ұОӘ¶юФӘИхјоЈ¬ФЪЛ®ЦРөДөзАл·ҪКҪУл°ұПаЛЖ | БӘ°ұУлБтЛбРОіЙөДЛбКҪСОөД»ҜС§КҪОӘЈә |
D | ·ўЙъ»ҜС§·ҙУҰКұЈ¬ҪУКЬөзЧУ¶ФөДОпЦКОӘЛбЈ¬МṩөзЧУ¶ФөДОпЦКОӘјо |
|
A. AB. BC. CD. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»·Ом¶юП©ЈЁ![]() Ј©ҝЙУГУЪЦЖұё¶юГҜМъЈЁ
Ј©ҝЙУГУЪЦЖұё¶юГҜМъЈЁ![]() Ј¬Ҫб№№јтКҪОӘ
Ј¬Ҫб№№јтКҪОӘ![]() Ј©Ј¬әуХЯ№г·әУГУЪәҪМмЎў»Ҝ№ӨөИБмУтЎЈ¶юГҜМъөДөз»ҜС§ЦЖұёФӯАнИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
Ј©Ј¬әуХЯ№г·әУГУЪәҪМмЎў»Ҝ№ӨөИБмУтЎЈ¶юГҜМъөДөз»ҜС§ЦЖұёФӯАнИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
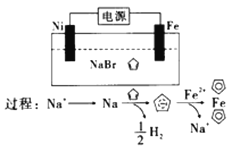
A. ![]() ОӘөзҪвіШөДСфј«
ОӘөзҪвіШөДСфј«
B. өзҪвЦКИЬТәҝЙТФКЗ![]() өДЛ®ИЬТә
өДЛ®ИЬТә
C. өзҪвіШөДЧЬ·ҙУҰ·ҪіМКҪОӘЈә![]()
D. өзҪвЦКИЬТәЦРЈ¬өұУР![]() өД
өД![]() Пт
Пт![]() өзј«ТЖ¶ҜКұЈ¬Н¬КұФЪ
өзј«ТЖ¶ҜКұЈ¬Н¬КұФЪ![]() өзј«ЙПІъЙъБЛ
өзј«ЙПІъЙъБЛ![]() өДЗвЖш
өДЗвЖш
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ25ЎжЈ¬101KPa ПВЈ¬Ҫ« V L ВИ»ҜЗвЖшМеИЬУЪЛ®өГ V L Л®ИЬТәЈ¬№ШУЪёГИЬТәөДРрКцХэИ·өДКЗ
A.ИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ 1 mol/LB.ИЬТәЦР cЈЁH+Ј©= ![]() mol/L
mol/L
C.ИЬТәЦРЛ®·ЦЧУКэәН H+КэЦ®ұИОӘ 1:1D.ИЬТәөДОпЦКөДБҝЕЁ¶ИЙФРЎУЪ![]() mol/L
mol/L
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com