
已知葡萄糖(C6H12O6)的燃烧热是2804kJ•mol﹣1,当它被氧化生成1mol水时放出的热量是()
A. 26.0kJ B. 5 1.9kJ C. 155.8kJ D. 467.3kJ
1.9kJ C. 155.8kJ D. 467.3kJ
考点: 有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据燃烧热的定义书写热化学方程式,根据方程式计算生成1mol水时放出的热量.
解答: 解:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,葡萄糖的燃烧热是2804kJ/mol,
说明1mol葡萄糖完全燃烧生成二氧化碳气体和液态水放出2804kJ的热量,则反应的热化学方程式为:C6H12O6(l)+6O2(g)=6CO2(g)+6H2O(l)△H=﹣2804KJ/mol,
则当它氧化生成1mol水时放出的热量是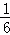 mol×2804KJ/mol=467.3kJ,
mol×2804KJ/mol=467.3kJ,
故选D.
点评: 本题考查燃烧热的计算,题目难度不大,正确书写热化学方程式是关键.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是()
①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 任何化学反应都伴随着能量的变化
B. 1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C. 在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)=4C(g)+2D(g),在不同条件下反应,其平均反应速率如下,其中反应速率最快的是()
A. v(A)=0.4mol/(L•s) B. v(B)=0.8mol/(L•s)
C. v(C)=1.2mol/(L•s) D. v(D)=0.7mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g),反应2min的时间,并测得该段时间内C的反应速率为0.6mol•L﹣1•min﹣1,现有下列几种说法中正确的是()
①用物质A表示的反应的平均速率为0.6mol•L﹣1•s﹣1
②用物质B表示的反应的平均速率为0.05mol•L﹣1•s﹣1
③2min时容器中A的物质的量为2.8mol
④2min时物质B的浓度为0.4mol•L﹣1.
A. ①③ B. ②④ C. ②③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
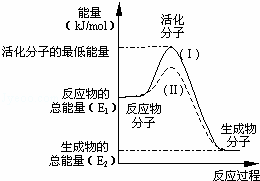
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+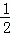 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1mL 1.0mol•L﹣1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示 (实验中始终保持V1+V2=50mL).下列叙述正确的是()
(实验中始终保持V1+V2=50mL).下列叙述正确的是()
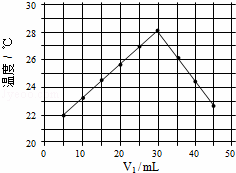
A. 做该实验时环境温度为20℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L•L﹣1
D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中,正确的是()
A. 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com