
某充电电池的原理如图186所 示,
示, 溶液中c(H+)=2.0 mol·L-1,阴离子为SO
溶液中c(H+)=2.0 mol·L-1,阴离子为SO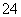 ,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )
,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )

图186
A.放电过程中,左槽溶液的颜色由黄色变为蓝色
B.充电过程中,a极的反应式为VO +2H++e-===VO2++H2O
+2H++e-===VO2++H2O
C.充电时,b极接直流电源的正极,a极接直流电源的负极
D.放电时,当转移1.0 mol电子时,共有2.0 mol H+从右槽迁移至左槽
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构简式如图所示。下列关于普伐他汀的性质描述不正确的是( )

A.该物质的分子式为C23H38O7
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、酯化、水解反应
D.1 mol该物质与溴水反应可消耗Br2 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。

完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________(填字母,下同)。
a.烧杯 b.玻璃棒
c.量筒 d.容量瓶
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收________________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:
航天器中常使用可充电电池,构造示意图如图184(氢化物电极为储氢金属,可看作H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )

图184
A.在使用过程中,此电池要不断补充水
B.放电时,NiOOH在电极上发生氧化反应
C.充电时,阳极反应式为Ni(OH)2-e-+OH-===NiOOH+H2O
D.充电时,阴极区的电解质溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是( )

图1 图2 图3 图4
A.用图1 所示装置除去Cl2中含有的少量HCl
B.用图2 所示装置蒸发结晶提纯后的粗盐溶液,得NaCl晶体
C.用图3 所示装置制取少量纯净的CO2气体
D.用图4 所示装置分离用苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
B. H2SO4与Ba(OH)2反应生成1mol水时放出的热叫做中和热
C. 热化学方程式中的化学计量数表示物质的量,可以是分数
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=______________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化合物:①NaOH, ②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4, ⑧NH4HSO4, ⑨NH3•H2O,
请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;
在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加NaHCO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入NH4Cl固体
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m n (填 “<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)____________________________________________________。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH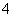 浓度由大到小的顺序是(填
浓度由大到小的顺序是(填
序号)________ 。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com