
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是
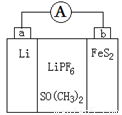
A.该装置将化学能转化为电能
B.电子移动方向是由a极到b极
C.可以用水代替SO(CH3)2做溶剂
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市高三3月统一质量检测理综化学试卷(解析版) 题型:填空题
钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有?????? (填元素符号)。
(2)[Ti(OH)2(H2O)4]2+中的化学键有???????? 。
A.σ键?? ? B.π键??? ?? C.离子键??? ?? D.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下图所示。
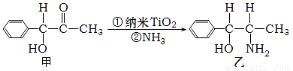
化合物甲的分子中采取sp2杂化方式的碳原子个数为???????? ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为???????? 。
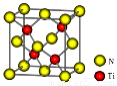
(4)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为???? ,该晶体中Ti原子周围与它距离最近且相等的N原子的个数______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com