
HF为一元弱酸,在0.1mol·L-1 NaF溶液中,离子浓度关系正确的是
A.c(Na+)>c(F-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(F-)>c(H+)
C.c(Na+) + c(OH-)=c(F-) + c(H+) D.c(Na+) + c(H+)=c(F-) + c(OH-)
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列试剂中,不能贮存在玻璃瓶中的是
A.浓硫酸 B.氢氟酸 C.浓氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列物质中,S元素的化合价为+6的是
A.S B.H2SO4 C.SO2 D.H2S
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
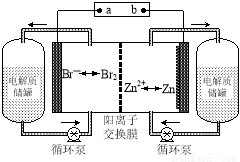
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市毕业班综合测试三 理综化学试卷(解析版) 题型:选择题
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:
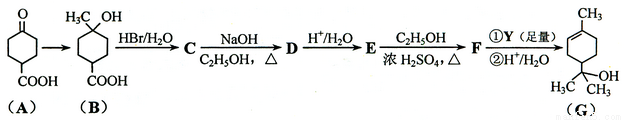
已知:RCOOC2H5 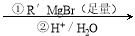
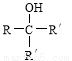
请回答下列问题:
⑴ A所含官能团的名称是________________(写出两个中任意一个)。
⑵ A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
____________________________________________________________________。
⑶ B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
(4) B → C、E → F的反应类型分别为_____________、_____________。
⑸C →D的化学方程式为______________________________________________。
⑹ 试剂Y的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg?L-1) | 成分 | 含量/(mg?L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42 | 2560 | Br- | 64 |
Mg2+ | 1272 |
|
|
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: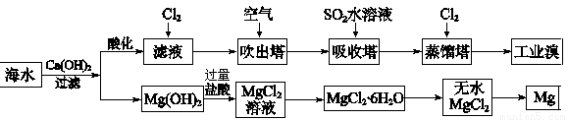
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
L(忽略Cl2溶解,溴的相对原子质量:80)。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃中 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:简答题
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题:
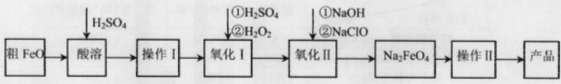
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律________________________________________________________。
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于油脂和乙酸乙酯的比较中,正确的是
A.油脂和乙酸乙酯都是纯净物,在室温下都是液体
B.油脂和乙酸乙酯都能水解生成羧酸和醇
C.油脂和乙酸乙酯都不能使溴水褪色
D.油脂和乙酸乙酯都不溶于水,而易溶于有机溶剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com