
分析 (1)燃烧热是指在25℃,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定氧化物据此解答;
(2)依据氢气燃烧的热化学方程式计算;
(3)根据盖斯定律,将反应③④做相应的变形即可;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
根据盖斯定律,将方程式2②-①计算即可.
解答 解:(1)根据燃烧热的定义,1mol氢气燃烧生成液态水更稳定,所以①H2(g)+$\frac{1}{2}$O2 (g)=H2O(l);△H=-285kJ•mol-1为氢气燃烧热的化学方程式,所以氢气的燃烧热为:285kJ•mol-1;根据燃烧热的定义,1mol碳完全燃烧生成二氧化碳时放出的热量为碳的燃烧热,④C(s)+O2 (g)=CO2(g);△H=-393.5kJ•mol-1为碳燃烧热的化学方程式,所以碳的燃烧热为:393.5kJ•mol-1;
故答案为:285kJ•mol-1;393.5kJ•mol-1;
(2)H2(g)+$\frac{1}{2}$O2 (g)=H2O(l);△H=-285kJ•mol-1 Q
2g 285kJ
1g 142.5KJ
所以燃烧1gH2生成液态水,放出的热量为142.5KJ,
故答案为:142.5KJ;
(3)由于CO的燃烧热的化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g),根据盖斯定律,将④-③即可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-393.5kJ/mol-(-241.8kJ/mol)=-151.7KJ/mol,故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-151.7KJ/mol;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1.
点评 本题考查了燃烧热的定义和反应热的求算,题目难度不大,理解燃烧热概念时注意:1、物质的物质的量必须是1mol;2、必须是完全燃烧生成稳定的氧化物.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③④⑥ | C. | ②③④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
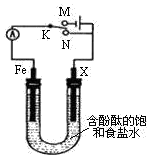
| A. | 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀 | |
| B. | 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 电键K置于M处,若X为碳棒,碳棒附近溶液变红 | |
| D. | 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com