
【题目】一种以2 molL-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
A. 放电时,NaTi2(PO4)3发生氧化反应
B. 放电时,Na+向锌棒一极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]--2e-=[Ti2(PO4)3]3-
D. 充电时,每转移0. 2 mol电子,阴极增重6.5 g
【答案】D
【解析】A、根据原电池的工作原理,正极上发生还原反应,化合价降低,负极上发生氧化反应,化合价升高,根据电池总反应,锌的化合价升高,因此锌为负极,发生氧化反应,NaTi2(PO4)3中Ti的化合价由+4价→+3价,化合价降低,因此NaTi2(PO4)3发生还原反应,故A错误;B、根据原电池工作原理,Na+向正极移动,故B错误;C、充电时,电池的正极接电源的正极,电池的负极接电源的负极,电池正极反应式为[Ti2(PO4)3]-+2e-=[Ti2(PO4)3]2-,充电时阳极反应式为[Ti2(PO4)3]2--2e-=[Ti2(PO4)3]-,故C错误;D、充电时阴极反应式为Zn2++2e-=Zn,每转移0.2mol电子,阴极增重6.5g,故D正确。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的性质比较,不正确的是( )
A. 稳定性:NH3<PH3<SiH4 B. 酸性:HClO4>H2SO4>H3PO4
C. 碱性:KOH>NaOH>Mg(OH)2 D. 还原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素的性质及其递变规律正确的是( )
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
在以上制备甲醇的两个反应中:反应I优于反应II,原因为_____________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH1=-Q1 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) ΔH2=-Q2 kJ/mol
③H2O(g)=H2O(l) ΔH3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:_______。
(3)某同学依据甲醇燃烧的反应原理,设计如下图所示的电池装置,工作一段时间后,测得溶液的pH将___________填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:________________。
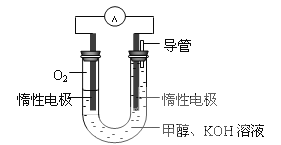
Ⅱ 325K、起始压强为100kPa时,在体积为2L的密闭容器中充入4.6 g NO2 ,发生反应:2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为________;

A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(2)能够说明上述反应已经达到平衡状态的有____________;
a.NO2和N2 O4的物质的量相等
b.体系颜色不在变化
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_______,此条件下的平衡常数K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A,B,C,D,E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知:A+B=D+F,A+C=E+F; 0.1 molL﹣1D溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.乙元素在周期表中的位置为第三周期第ⅣA族
C.1 molA与足量B完全反应共转移了1 mol电子
D.1.0 L 0.1 molL﹣1E溶液中阴离子总的物质的量小于0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含SO![]() 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是 ( )
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是 ( )
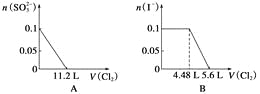

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com