
分析 ①在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上发生得电子的还原反应,结合电解质环境来书写电极反应式即可;
②根据电池反应判断溶液酸碱性的变化;
③根据燃料电池的特点结合能量转化来判断.
解答 解:①在甲烷燃料电池中,通入甲烷的电极是负极,通入氧气的电极是正极,碱性环境下工作时正极电极反应方程式:2H2O+O2+4e-=4OH-;故答案为:负极;2H2O+O2+4e-=4OH-;
②甲烷和氧气燃料电池进行工作时,总反应式为CH4+2O2+2KOH═K2CO3+3H2O,随着电池不断放电,氢氧化钾被消耗,所以电解质溶液的碱性减小,故答案为:减小;
③通常情况下,甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率,故答案为:大于.
点评 本题考查甲烷燃料电池的电极反应式、总方程式及应用方面的知识,难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
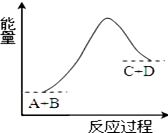
| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应中D的能量可能大于反应物A和B的能量之和 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
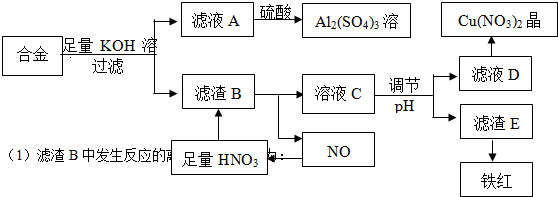
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com