
 N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
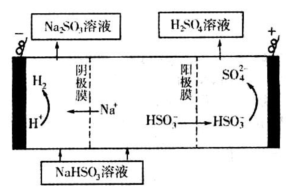
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
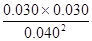 =0.56。
=0.56。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+4H2(g)
CO2(g)+4H2(g)
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
 CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
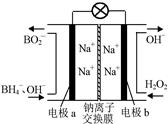
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |

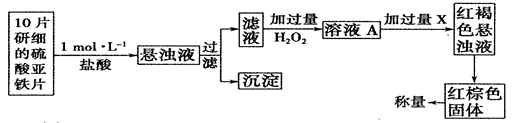
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
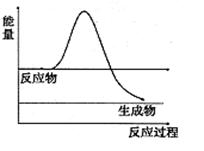
已知:① Cu(s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+2H2O(l) △H 1 ②2H2O(l)=2H2(g)+O2(g) △H 2 ③2H2O2(l)=2H2O(l)+O2 (g) △H 3 ④Cu(s)+2H+ (aq)=Cu2+(aq)+H2 (g) △H4 则ΔH4的正确表达式为( )
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+ H2(g);
CO(g)+ H2(g); CO (g)+ 3H2(g)
CO (g)+ 3H2(g)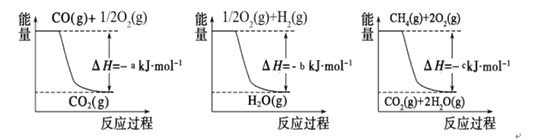
 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com