
【题目】①丁烷 ②2一甲基丙烷 ③戊烷 ④2一甲基丁烷 ⑤2,2—二甲基丙烷等物质的沸点排列顺序正确的是 ( )
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平衡,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4![]() MgxMo3S4;在镁原电池放电时,下列说法错误的是 ( )
MgxMo3S4;在镁原电池放电时,下列说法错误的是 ( )
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe-===Mo3S![]()
C.Mo3S4发生氧化反应
D.负极反应为:xMg-2xe-===xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
A.CH4 B.C4H10 C.C2H6 D.C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
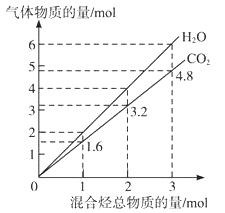
①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ②⑤⑥ B. ②⑥ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为自发进行的氧化还原反应,将其设计成如右图所示的原电池,下列说法中正确的是( )

A. 铜电极是正极,其电极反应为Cu-2e-===Cu2+
B. 当铜电极质量减少0.64 g时,电解质溶液中有0.02 mol电子通过
C. 装置盐桥中可装有含琼脂的KCl饱和溶液
D. 银电极上发生还原反应,电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下图实验装置探究盐桥式原电池的工作原理,按照要求依次回答下列问题:

(1)写出该氧化还原反应的离子方程式:_______________
(2)装置中盐桥中除添加琼脂外,还要添加KCl的饱
和溶液,电池工作时,对盐桥中的K+、Cl-的移
动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)已知该原电池装置在反应前两电极质量相等,一段时间后两极质量相差12.9 g
则导线中通过的电子数目为________ (用“NA”表示);
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则原电池的负极材料是________,正极发生的电极反应为:__________________。
(5)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:①则d电极是________(填“正极”或“负极”)C电极的反应方程式为:_____________

②若电路中转移4 mol电子,则上述燃料电池消耗的O2在标准状况下的体积为____L。
③电池工作一段时间后溶液的酸性_________(填“增强”“减弱”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 B. Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 C. 乙醇和乙酸都能溶于水,都是电解质 D. 分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:

请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略)。观察到的现象是______________,
写出铜与氯气反应的化学方程式 ______________________。
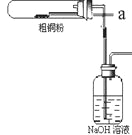
(2)上述流程中固体K溶于稀盐酸的目的是___________________。试剂X、固体J的物质分别为____________________。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式____________________。
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是_____________。该腐蚀过程的正极反应式为___________________。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
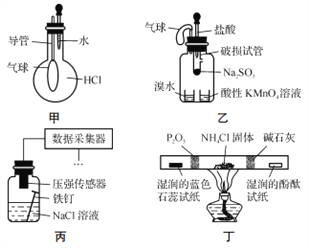
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com