
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
(1)写出碳酸锶与盐酸反应的离子方程式_______________。
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜选用的试剂为__________(写一种)。
(3)关于上述流程中各步骤的说法,正确的是_____________。
A.调节pH后加热煮沸的原因是除去H2O2,并避免生成Fe(OH)3胶体
B.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
C.可以通过加快结晶速率的方法来得到较大颗粒的SrCl2·6H2O 晶体
D.步骤⑥干燥SrCl2·6H2O晶体可以采用减压干燥
(4)为了测定所得SrCl2·6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.200mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,当_______________时达到滴定终点,用去NH4SCN溶液20.0mL,则原SrCl2·6H2O晶体的纯度为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钙基固硫”是将煤中的硫元素以CaSO4的形式固定脱硫,而煤炭燃烧过程中产生的CO又会发生反应I和反应II,导致脱硫效率降低。某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是
反应I:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
反应II:CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,合成氨反应:N2 (g ) + 3H2 ( g ) ![]() 2NH3 ( g ) △H =-92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H =-92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定小于92.0 kJ
C. 一定等于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
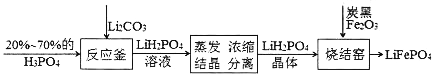
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
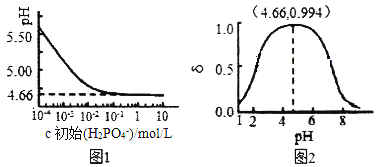
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8.若配置该营养液,取214gNH4Cl,则需KCl和K2SO4的质量分别为( )
A.53.5g和214gB.37.25g和348g
C.74.5g和696gD.149g和696g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g) ![]() pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
(1)该反应的逆反应是________反应(填“放热”或“吸热”),且a+b______p(填“<”、“>”或“=”)。
(2)温度、容器体积不变,平衡后加入B,A的转化率_________,B的转化率_________。(填“增大”、“减小”或“不变”)
(3)若升高温度,再次平衡时,B、C的浓度之比将_____________。(填“增大”、“减小”或“不变”)
(4)若加入催化剂,再次平衡时气体混合物的总物质的量___________。(填“增大”、“减小”或“不变”)
(5)若B是有色气体,A、C无色,平衡后压缩容器体积为原来的一半,再次平衡时,容器内气体颜色____。若维持容器内气体压强不变,充入Ne,再次平衡时,容器内气体颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com