
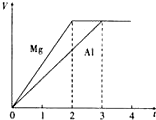
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素是同分异构体 |
| B、淀粉、蛋白质、油脂都属于天然高分子化合物 |
| C、植物油不能使溴的四氯化碳溶液褪色 |
| D、油脂在酸性条件下水解与在碱性条件下水解,产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2气体通入NaAlO2溶液中 |
| B、SO2气体通入BaCl2溶液中 |
| C、CO2气体通入饱和Na2CO3溶液中 |
| D、SO2气体通入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有吸水性 |
| B、浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处 |
| C、金属钠着火燃烧时,可用泡沫灭火器灭火 |
| D、正常雨水pH等于7,酸雨的pH小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子或分子结构、单质或化合物相关信息 | |
| X | 含X元素的物质焰颜色反应为黄色 |
| Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z | Z元素原子易失去2个电子形成8电子结构的离子 |
| M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子的最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com