
 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变;
(2)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
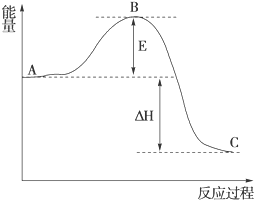
(3)①根据图象来分析;
②反应的反应热取决与反应物和生成物总能量的差值;催化剂能参与反应,降低反应的活化能;
③根据参加反应SO2的物质的量之比等于对应的△H之比来计算.
解答 解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变,在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,1mol甲烷燃烧生成稳定氧化物放热880KJ,表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
故答案为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
(2)已知①2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
②2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
根据盖斯定律,$\frac{1}{2}$(①-②)得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=$\frac{1}{2}$(△H1-△H2)=$\frac{1}{2}$(-702kJ/mol+182kJ/mol)=-260kJ/mol,
故答案为:-260kJ/mol.
(3)①根据图象可知,E为正反应的活化能,C为生成物的总能量,故答案为:正反应活化能,生成物总能量;
②反应的反应热取决与反应物和生成物总能量的差值,与正逆反应的活化能无关,即E的大小不影响反应热;催化剂能参与反应,改变反应的路径,降低反应的活化能,故能使B点降低,故答案为:无,降低,因为催化剂改变了反应的历程使活化能E降低;
③因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198kJ•mol-1,故答案为:-198kJ•mol-1.
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠熔成光亮的小球,在液面四处游动 | |
| B. | 有气体产生 | |
| C. | 溶液底部有银白色的物质 | |
| D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的盐酸中,镁溶解有气泡产生,而铝没有任何变化 | 镁的金属性比铝强 |
| B | 取一块铝箔,用酒精灯点燃,铝箔只熔化成液体 | 铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片,铝上产生大量气泡 | 该气体是氢气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 氢氧化铝能溶解于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com