
| A. | 电子式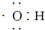 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌 | |
| D. | 原子结构示意图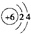 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:多选题
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗a mol A,同时生成3a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体中B物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和氯化铁溶液滴入氢氧化钠溶液中即可 | |
| B. | 将饱和氯化铁溶液滴入热水中,生成棕黄色液体即可 | |
| C. | 将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色液体即可 | |
| D. | 将饱和氯化铁溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.05×10-4mol/L | B. | 5.26×10-4mol/L | C. | 5.05×10-3mol/L | D. | 5.26×10-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分子中至少有9个碳原子处于同一平面上 分子中至少有9个碳原子处于同一平面上 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是3,3-二甲基-1-丁烯 | |
| D. | 能够测定分子化学键的方法是核磁共振谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.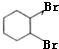 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,反应类型消去反应;
+2NaBr+2H2O,反应类型消去反应;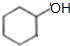 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型消去反应;
+H2O,反应类型消去反应; +HBr$\stackrel{一定条件}{→}$
+HBr$\stackrel{一定条件}{→}$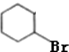 +H2O,反应类型取代反应;
+H2O,反应类型取代反应; +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com