
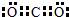 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为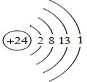
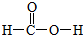 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g. 分析 Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,结合原子的结构和性质解答.
解答 解:Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,
综上所述:Q为氢,R为碳,X为氮,Y为氧,Z为铬,
(1)C、N、O的第一电离取决于元素非金属性的强弱,但是由于N的2p能级上电子处于半充满的相对稳定状态,故C、N、O的第一电离能由大到小的顺序为N>O>C,
故答案为:N>O>C;
(2)Q元素为H,H在元素周期表中属于第一周期第ⅠA族,即s区,Y为O,与O元素同族(最外层电子数为6)的第四周期元素的价电子排布式为为:4s24p4,
故答案为:s;4s24p4;
(3)RY2为CO2,二氧化碳中,C与O形成两对共用电子对,故电子式为: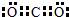 ,Z3+的原子结构示意图为:
,Z3+的原子结构示意图为: ,
,
故答案为: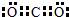 ;
; ;
;
(4)RQ2Y2为:CH2O2,即甲酸,甲酸的结构式为: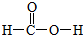 ,
,
甲酸燃烧生成二氧化碳和水,2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
HCOOH~CO2+H2O~△m
46 62 30
m x
x=$\frac{15m}{23}$,故燃烧m g甲酸完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为:$\frac{15m}{23}$,
故答案为: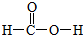 ;$\frac{15m}{23}$.
;$\frac{15m}{23}$.
点评 本题考查了物质结构和性质,元素周期律的知识,这些知识点是学习重点,根据原子结构正确判断元素是解本题关键,再结合基本概念、基本规律等知识点来分析解答,难度较大.


科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.加大石油、煤炭的开采速度,增加化石燃料的供应量
B.推广使用燃煤脱硫技术,防治SO2污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.实施绿化工程,防治扬尘污染
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
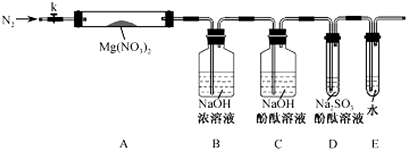
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
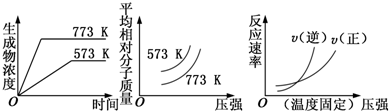
| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致化学平衡向左移动 | |
| B. | 合成氨工业中,使用铁催化剂可加快正反应速率,提高N2、H2的转化率 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘酒中的碘和酒精 | B. | 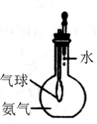 验证氨气易溶于水 | ||
| C. | 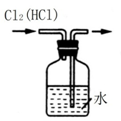 除去Cl2中的HCl杂质 | D. | 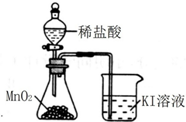 比较MnO2、Cl2、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+、另需实验验证 | |
| B. | 肯定存在的离子是SO32-、Br-,且Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com