
| A����СNO2��Ũ�� | B�������¶� | C������NO2��Ũ�� | D�������¶� |
 N2O4(g)��ƽ�ⳣ��K��
N2O4(g)��ƽ�ⳣ��K��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
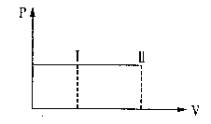
 bB(g)�ﵽƽ������¶Ȳ��䣬�������������1�������ﵽ��ƽ��ʱ��8��Ũ����ԭ����60��������˵����ȷ����
bB(g)�ﵽƽ������¶Ȳ��䣬�������������1�������ﵽ��ƽ��ʱ��8��Ũ����ԭ����60��������˵����ȷ����| A��ƽ��������Ӧ�����ƶ��� |
| B������A��ת���ʼ����� |
| C������B���������������� |
D��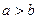 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)+6H2O(g)��10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ������
4NO(g)+6H2O(g)��10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˷�Ӧ��ƽ������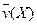 ����Ӧ����������ʻ������������ʣ��ɱ�ʾΪ�� ��
����Ӧ����������ʻ������������ʣ��ɱ�ʾΪ�� ��A��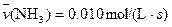 | B��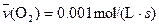 |
C�� | D��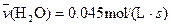 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4Y(g)��Z(g)����H��0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ�
4Y(g)��Z(g)����H��0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ� ����
����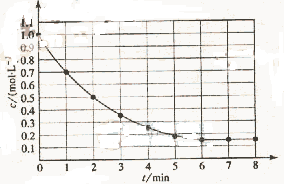

 �����йظ÷�Ӧ��������ȷ����
�����йظ÷�Ӧ��������ȷ����
A����6 min ��Ӧ����ֹ�� | B��X��ƽ��ת����Ϊ85% | C���������¶ȣ�X��ƽ��ת���ʽ�����85% | D���������¶ȣ�v����v������ͬ��������С  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ﵽ��ѧƽ��ʱ��N2����ȫת��ΪNH3 |
| B���ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ��һ����� |
| C���ﵽ��ѧƽ��ʱ������Ӧ���淴Ӧ�����ʶ�Ϊ�� |
| D���ﵽ��ѧƽ��ʱ��N2��H2��NH3�����ʵ���Ũ�Ȳ��ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ||
| A����λʱ��������nmolO2��ͬʱ����2nmolNO2 |
| B����λʱ��������nmolO2��ͬʱ������2nmolNO |
| C����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬ |
| D������������ɫ�����ı��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѹ��ʹ�÷�Ӧ�ķ�Ӧ���ʱ�� |
| B���÷�Ӧ���γ��»�ѧ���ͷŵ��������ڶ��Ѿɻ�ѧ������Ҫ���յ����� |
| C����2molSO2��1molO2��Ͻ��з�Ӧ����Ӧ���ʱ����2molSO3 |
| D����λʱ��������2molSO3��ͬʱ����1molO2˵���÷�Ӧ�ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 B��g��+3C��g������������״̬ʱ����ƽ��״̬���ǣ�������
B��g��+3C��g������������״̬ʱ����ƽ��״̬���ǣ�������| A������Ӧ���ʣ�v��A��=2mol?L-1?s-1 �淴Ӧ���ʣ�v��C��=2mol?L-1?s-1 |
| B������Ӧ���ʣ�v��A��=2mol?L-1?s-1 �淴Ӧ���ʣ�v��B��=1.5mol?L-1?s-1 |
| C������Ӧ���ʣ�v��A��=2mol?L-1?s-1 �淴Ӧ���ʣ�v��B��=2mol?L-1?s-1 |
| D������Ӧ���ʣ�v��A��=1mol?L-1?s-1 �淴Ӧ���ʣ�v��C��=1.5mol?L-1?s-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com