
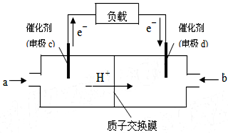
分析 (1)所有燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子、正极上得电子,放电时电子从负极沿导线流向正极,根据图知,c是负极、d是正极,电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(2)用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,同时电解质溶液中还生成硫酸;
(3)通电一段时间后,某电极质量增加1.92g,该电极是阴极,析出的是Cu单质,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,根据转移电子相等计算消耗甲醇质量;
(4)要使电解后的溶液恢复原状,采用“析出什么加入什么”原则确定加入物质.
解答 解:(1)所有燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子、正极上得电子,放电时电子从负极沿导线流向正极,根据图知,c是负极、d是正极,电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为2CH3OH+2H2O-12e-═2CO2+12 H+,
故答案为:负极;2CH3OH+2H2O-12e-═2CO2+12H+;
(2)用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,同时电解质溶液中还生成硫酸,电池反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)通电一段时间后,某电极质量增加1.92g,该电极是阴极,析出的是Cu单质,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,根据转移电子相等计算消耗甲醇质量=$\frac{0.03mol×2}{6}×32g/mol$=0.32g,故答案为:0.32g;
(4)要使电解后的溶液恢复原状,采用“析出什么加入什么”原则确定加入物质,电解硫酸铜溶液时,阳极上析出氧气、阴极上析出Cu,所以相当于析出CuO,还可以加入碳酸铜,因为碳酸铜和稀硫酸反应生成硫酸铜和二氧化碳、水,所以还相当于加入CuO,要使溶液恢复原状可以加入CuO或CuCO3,故答案为:CuO或CuCO3.
点评 本题考查化学电源新型电池、电解原理等知识点,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,注意(4)中加入物质确定方法,为易错点.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题

 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,持续通入一段时间后,CCl4层变为棕色 | ⑨单质、Br2、Fe3+的氧化性由强到弱的顺序是: ⑨单质(或Cl2)>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 营养平衡、科学使用食品添加剂有助于健康和提高免疫力.
营养平衡、科学使用食品添加剂有助于健康和提高免疫力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
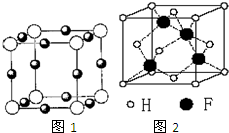 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com