
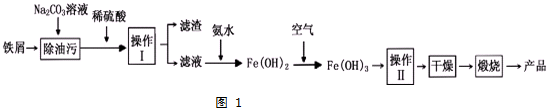
分析 (1)①铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入氨水得到氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl;
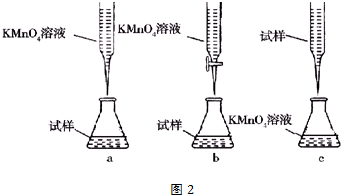
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,滴入最后一滴酸性高锰酸钾溶液,若溶液变红色,说明亚铁离子反应完全,滴定到达终点;
步骤a:Fe2+被氧化为Fe3+,用KSCN溶液检验是否含有Fe3+;
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大;
③根据离子方程式计算n(Fe2+),由Fe元素守恒可知n(FeSO4•7H2O)=n(Fe2+),再根据m=nM计算m(FeSO4•7H2O),进而计算样品中FeSO4•7H2O的质量分数.
解答 解:(1)①铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入氨水得到氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁,则:操作Ⅱ所包含的两项主要基本操作是:过滤、洗涤,上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:过滤、洗涤;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,需要有氧气参与反应,反应还生成HCl,反应方程式为:4FeCl2+4H2O+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8HCl,
故答案为:4FeCl2+4H2O+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8HCl;
(2)高锰酸钾溶液具有强氧化性,将Fe2+氧化为Fe3+,自身为还原为Mn2+,反应离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色,不需要另外加入指示剂,
步骤a,Fe2+被氧化为Fe3+,所以事先取少量绿矾产品溶于水,滴加KSN溶液进行验证,若溶液变红色,说明被氧化,否则未被氧化,
①配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性,盛放在酸式滴定管中,样品硫酸亚铁溶液呈酸性,应用酸式滴定管盛放,且向锥形瓶滴加硫酸亚铁溶液,与空气接触增大,会被氧气氧化,导致误差增大,故b最合理;
③n(MnO4-)=0.01000mol/L×0.02L=2×10-4mol,由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可知n(Fe2+)=5×2×10-4mol=1×10-3mol,
所以250mL溶液中含有知n(Fe2+)=1×10-3mol×$\frac{250mL}{25mL}$=1×10-2mol,
则m(FeSO4•7H2O)=278g/mol×1×10-2mol=2.78g,
样品中FeSO4•7H2O的质量分数为$\frac{2.78g}{2.850g}$×100%=97.5%,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;否;a.KSCN;①250mL容量瓶;②b;③97.5%.
点评 本题考查化学工艺流程、物质的分离提纯、氧化还原滴定应用、溶液配制等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3$\stackrel{△}{→}$Al2O3(熔融)$\stackrel{电解}{→}$Al | |
| B. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$Cu | |
| C. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<2 | B. | X只能位于第三周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com