
分析 (1)氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液.
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: .
.
点评 本题考查了原电池设计,知道哪些反应能设计成原电池,根据反应中元素化合价变化确定正负极、电解质溶液,原电池设计是学习难点,也是考试热点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: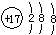 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | Na+的电子式:Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子半径比Y的大 | B. | X原子的最外层电子数比Y的大 | ||
| C. | X的原子序数比Y的小 | D. | X元素的最高正价比Y的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
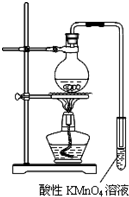 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com