
A.若x=y,pH(NaA)>pH(NaB),则酸性HA>HB
B.若x=y,并测得c(A-)=c(B-)+c(HB),则酸性HB>HA
C.若x=y,且两溶液中c(HA)<c(HB),则两溶液中一定有:c(A-)>c(B-)
D.等体积混合两溶液,测得混合溶液中c(A-)+c(B-)+c(HA) +c(HB)=0.1 mol·L-1,则一定能推出x=y=0.1
科目:高中化学 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:038
现有某种碱金属元素组成的两种碳酸盐(正盐和酸式盐)的混合物4.86 g,加水溶解后,取所得溶液的![]() ,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.
,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.
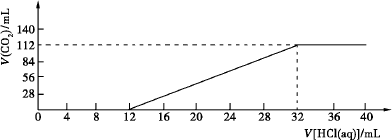
请计算:(1)原混合物中碳元素的质量分数.
(2)确定此两种碳酸盐的化学式.
(3)所滴加盐酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
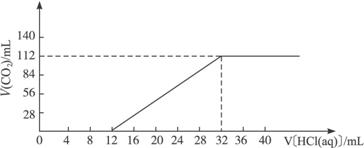
请计算:
(1)原混合物中碳元素的质量分数。
(2)确定此两种碳酸盐的化学式。
(3)所滴加盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E五种物质,它们有如下反应关系:

(1)若A是由短周期中原子半径最大的元素与地壳中含量最多的元素组成的离子化合物,且两种元素的原子个数比为1:1。则A中存在的化学键是 、 。
(2)若A是可溶性强碱,B是正盐,E不溶于稀硝酸,则B的化学式为 ,
(3)若A是NaHCO3,B是正盐,E既可溶于盐酸又可溶于NaOH溶液,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有两种正盐的稀溶液,分别是x mol/LNaA溶液和y mol/LNaB溶液,下列说法正确的是 ( )
A.若x=y,pH(NaA)>pH(NaB),则酸性HA>HB
B.若x=y,并测得c(A-) = c(B-)+ c(HB),则酸性HB>HA
C.若x=y,且两溶液中c(HA)<c(HB),则两溶液中一定有:c(A-)>c(B-)
D.等体积混合两溶液,测得混合溶液中c(A-) + c(B-)+ c(HA) +c(HB)=0.1mol/L,则一定能推出x=y=0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com