

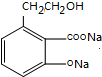
 ,反应②为醇的催化氧化,则B为
,反应②为醇的催化氧化,则B为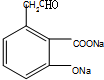 ,酸化得到C,则C为
,酸化得到C,则C为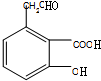 ,反应⑥为与氢气加成结合最终生成芳香酯E,则D为
,反应⑥为与氢气加成结合最终生成芳香酯E,则D为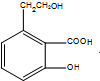 ,反应⑦在浓硫酸加热条件下发生酯化生成E,则E为
,反应⑦在浓硫酸加热条件下发生酯化生成E,则E为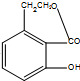 ,据此分析解答;
,据此分析解答; ,反应②为醇的催化氧化,则B为
,反应②为醇的催化氧化,则B为 ,酸化得到C,则C为
,酸化得到C,则C为 ,反应⑥为与氢气加成结合最终生成芳香酯E,则D为
,反应⑥为与氢气加成结合最终生成芳香酯E,则D为 ,反应⑦在浓硫酸加热条件下发生酯化生成E,则E为
,反应⑦在浓硫酸加热条件下发生酯化生成E,则E为 ;
; ,其中含有的官能团的名称为醛基、羧基、酚羟基;
,其中含有的官能团的名称为醛基、羧基、酚羟基; ,反应④只反应羧酸不反应酚羟基,只应该选用NaHCO3溶液,
,反应④只反应羧酸不反应酚羟基,只应该选用NaHCO3溶液,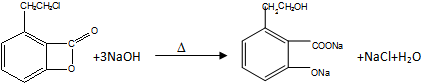
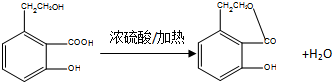 ;
; ;
; .
.


科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、稀释Na2CO3溶液时,
| ||||||
B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||||
| C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | ||||||
| D、常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
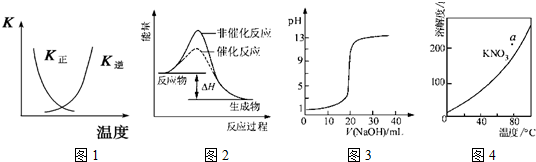
| A、图1表示该可逆反应平衡后,随温度升高,平衡会逆向移动 |
| B、图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C、图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液所得到的滴定曲线 |
| D、图4表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
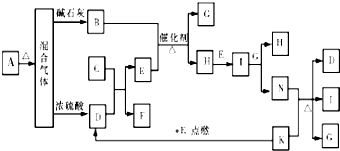
查看答案和解析>>
科目:高中化学 来源: 题型:
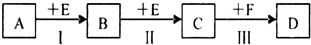
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com