
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
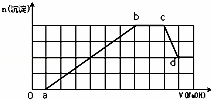
A. d点溶液中含有的溶质只有Na2SO4
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
D. 原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
考点: 常见离子的检验方法;离子方程式的有关计算.
专题: 计算题.
分析: 加入NaOH溶液后,在0﹣a段没有生成沉淀,说明溶液中一定存在H+或HCO3﹣离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在Al3+,由于HCO3﹣和Al3+会发生双水解而不能共存,则只能存在H+;
a﹣b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c﹣d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH﹣~AlO2﹣可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为3价离子,则为Fe3+;
b﹣c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+;
A、d点氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
B、根据以上分析判断溶液中一定存在的离子、铁离子与铝离子物质的量之比;
C、ab段为铁离子、铝离子与氢氧化钠反应生成氢氧化铁、氢氧化铝沉淀;
D、根据分析判断溶液中一定不存在镁离子,一定存在铁离子.
解答: 解:加入0﹣a段,加入NaOH溶液后没有生成沉淀,说明溶液中一定存在H+或HCO3﹣,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在铝离子,由于HCO3﹣和Al3+会发生双水解而不能共存,所以一定不存在HCO3﹣,因此一定存在H+;
a﹣b段生成沉淀消耗了6体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c﹣d段部分沉淀溶解,可知一定存在Al3+,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由OH﹣~AlO2﹣可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为+3价离子,只能为Fe3+,故原溶液中一定不存在Mg2+;
再由b﹣c段沉淀的物质的量不变,说明氢氧根离子与NH4+发生了反应,即溶液中一定存在NH4+;
根据溶液呈电中性可知,溶液中一定存在SO42﹣,
A、d点氢氧化铝与氢氧化钠溶液恰好完全反应生成NaAlO2,所以溶液中含有的溶质为Na2SO4、NaAlO2,故A错误;
B、根据图象可知生成沉淀用了6a体积的氢氧化钠,其中氢氧化铝溶解消耗了a体积的氢氧化钠,所以生成氢氧化铝需要消耗3a体积的NaOH溶液,还有3a体积的NaOH溶液一定是被Fe3+消耗,即铁离子与铝离子消耗的氢氧化钠溶液的体积相同,故原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故B正确;
C、根据以上分析可知,ab段发生的离子反应为铁离子、铝离子与氢氧根离子的反应,反应的离子方程式为:Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,故C错误;
D、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在镁离子,故C错误;
故选B.
点评: 本题考查了离子检验的方法应用,题目难度中等,氢氧化铝是两性氢氧化物溶于强碱是解题关键,本题难点在于如何根据图象中的数据判断铁离子的存在及根据溶液电中性判断一定存在硫酸根离子.


科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol•L﹣1 NH4Al(SO4)2中c(NH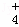 ) (填“等于”“大于”或“小于”)0.1mol•L﹣1 NH4HSO4中c(NH
) (填“等于”“大于”或“小于”)0.1mol•L﹣1 NH4HSO4中c(NH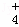 ).
).
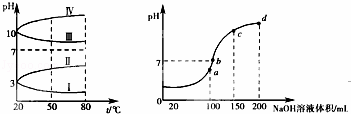
(3)如图1所示是0.1mol•L﹣1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写序号),导致pH随温度变化的原因是 ;
②20℃时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO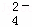 )﹣c(NH
)﹣c(NH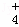 )﹣3c(Al3+)= (填数值).
)﹣3c(Al3+)= (填数值).
(4)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是 点;在b点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
把100mL含有MgSO4和K2SO4的混合溶液分成二等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A. 20(2b﹣a) mol/L B. 20(b﹣2a) mol/L C. 10(2b﹣a) mol/L D. 10(b﹣2a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素及其化合物与社会、生活关系密切.下列有关说法错误的是( )
A. 加碘食盐中加入的是KIO3
B. 常用于杀菌消毒的84消毒液的主要成份是NaClO
C. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D. 变色眼镜和照相器材的生产都可能要用到溴化银
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A NH4Cl为强酸弱碱盐 用加热法除去NaCl中的NH4Cl
B Fe3+具有氧化性 用KSCN溶液可以鉴别Fe3+
C 溶解度:CaCO3<Ca(HCO3)2 溶解度:Na2CO3<NaHCO3
D SiO2可与HF反应 氢氟酸不能保存在玻璃瓶中
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
如图图表示各物质之间的转化关系.
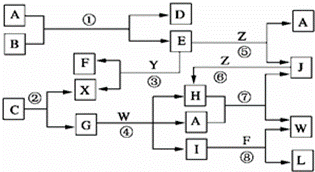
已知:
(1)A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y和Z都是气体;
(2)G、X、Y和Z都是单质,其它是化合物,其中Y呈黄绿色,H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成.
(3)B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且价态也相同,B中非金属元素的质量分数为28%,组成B的金属元素原子核外的K层和M层电子数相同.
请根据以上信息完成下列要求:
(1)写出下列物质的化学式:C ,F ,H
(2)写出E的电子式
(3)实验室制Y的离子方程式为
(4)上述反应中是氧化还原反应的除了②、③、④和⑦外,还有(填反应代号)
(5)写出反应①④⑤的化学反应方程式
①
④
⑤
(6)保持容器的温度和体积不变,在反应③刚好完全反应时,反应前后容器的压强之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于氧化反应的是( )
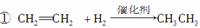
②2CH3CHO+O2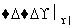 2CH3COOH
2CH3COOH
③CH3CHO+2Cu(OH)2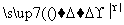 CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
④CH3CHO+H2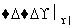 CH3CH2OH
CH3CH2OH
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列情况可能引起水污染的是( )
①农业生产中农药化肥使用不当
②生活中大量使用含磷洗涤剂
③工业生产中废气、废液、废渣排放不当
④生活污水的任意排放
⑤石油运输过程中因泄漏流入江河
⑥原子核反应的残留物随意排放.
A.①③⑤⑥ B.①③④⑤ C.①③⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a>c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com