
| A、H2(g)+Cl2(g)?2HCl(g);△H=-92.3 kJ/mol | B、H2(g)+Cl2(g)?HCl(g);△H=+92.3kJ/mol | C、H2+Cl2?2HCl;△H=-184.6kJ/mol | D、2HCl(g)?H2(g)+Cl2(g);△H=+184.6kJ/mol |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
 某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.查看答案和解析>>
科目:高中化学 来源: 题型:
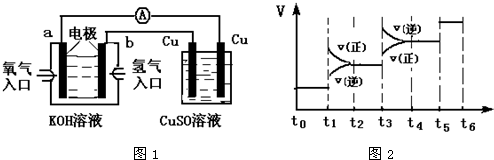
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| a2 |
| 4 |
| a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

| 4 |
| a2 |
| 4 |
| a2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com