
分析 6.72克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故白色沉淀中加入过量的稀盐酸,充分反应后,根据生成的二氧化碳的物质的量计算出BaCO3的物质的量,从而求出BaCO3的质量,根据混合物共为6.72g,即可求出BaSO4的质量和物质的量,而Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量.据此分析.
解答 解:根据分析可知,6.72克白色沉淀是BaCO3和BaSO4混合物.而BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故将沉淀与过量的盐酸反应,BaCO3溶解,生成的二氧化碳的物质的量为n=$\frac{0.448L}{22.4L/mol}$=0.02mol,设BaCO3的物质的量为xmol,则有:
1molBaCO3 ~1molCO2,
1 1
xmol 0.02mol
故有:$\frac{1}{xmol}=\frac{1}{0.02mol}$
解得x=0.02mol
故BaCO3的质量m=0.02mol×197g/mol=3.94g
由于混合物共为6.72g,故BaSO4的质量m=6.72g-3.94g=2.78g,故BaSO4的物质的量n=$\frac{2.78g}{233g/mol}$=0.012mol
而Na2SO4的物质的量等同于BaSO4的物质的量,故Na2SO4的物质的量为0.012mol,则物质的量浓度为c=$\frac{0.012mol}{0.1L}$=0.12mol/L;
Na2CO3的物质的量等同于BaCO3的物质的量,故Na2CO3的物质的量为0.02mol,则物质的量浓度为c=$\frac{0.02mol}{0.1L}$=0.2mol/L.
答:溶液中的Na2SO4和Na2CO3的物质的量浓度分别为0.12mol/L和0.2mol/L.
点评 本题考查混合物的有关计算,难度不大,清楚反应过程、理解反应步骤是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2 | |
| B. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O | |
| C. | 氯化钙溶液与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 铜片插入硝酸银溶液中Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离甲苯和二甲苯混合物 | B. | 分离硝酸苯和水的混合物 | ||
| C. | 分离碳酸钡和碳酸钠溶液 | D. | 分离碘的四氯化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若二氧化碳气体中混有少量的一氧化碳气体,可用点燃的方法除去 | |
| B. | 将铜粉中混有的少量铁粉除去,加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥 | |
| C. | 将KNO3固体中混有的少量NaCl固体除去,可以用冷却KNO3的热饱和溶液、过滤即可 | |
| D. | 若氧气中混有少量的二氧化碳气体,可将混合气体通过足量的NaOH溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
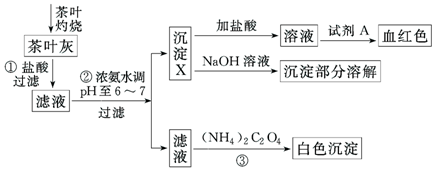
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe═Fe2++2e- | B. | Cu2++2e-═Cu | C. | Fe═Fe3++3e- | D. | Zn═Zn2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 在强碱性溶液中,[Al(OH)4]-、HCO3-、Na+、Ca2+可能同时大量共存 | |
| C. | 铁船底镶嵌锌块,构成原电池,锌作负极,以防船体被腐蚀 | |
| D. | 用量筒量取10.mL 1.0mol/L的盐酸于100mL溶液瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、SiO32- | B. | Fe3+、Ba2+、I-、NO3- | ||
| C. | NH4+、K+、S2-、SO32- | D. | H+、Ca2+、F-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com