
【题目】在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①﹣⑤中适当的物质,使有连线的两种物质能发生反应.
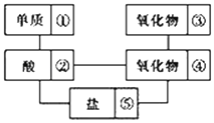
(1)请推断出它们的化学式分别为:①________;②________;③________;④________.
(2)写出下列序号之间反应的化学方程式:
②和④:________;
②和⑤:________.
【答案】 Fe H2SO4 CO2 CaO H2SO4+CaO=CaSO4+H2O H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
【解析】
在题目提供的物质中,单质①与酸②反应,则①为Fe、②为H2SO4,酸能与盐⑤反应,则⑤为Na2CO3,氧化物④能与②反应,则④为CaO,氧化物③能与氧化物④反应,则③为CO2,据此解答。
(1)在题目提供的物质中,单质①与酸②反应,则①为Fe、②为H2SO4,酸能与盐⑤反应,则⑤为Na2CO3,氧化物④能与②反应,则④为CaO,氧化物③能与氧化物④反应,则③为CO2,
因此,本题正确答案是: Fe; H2SO4 ;CO2 ;CaO;
(2)②和④反应的化学方程式:H2SO4+CaO=CaSO4+H2O;
②和⑤反应的化学方程式:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
因此,本题正确答案是:H2SO4+CaO=CaSO4+H2O;H2SO4+Na2CO3=Na2SO4+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为2∶3,因而可以说
A. 该有机物中含C、H、O三种原子
B. 该化合物是乙烷
C. 该化合物中C、H原子个数比为2:3
D. 该化合物中含C原子和H原子,但不能确定是否含有O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:2NO2(g)![]() N2O4(g)。下列说法正确的是
N2O4(g)。下列说法正确的是
A. 混合气体平均相对分子质量不变时,反应达到平衡状态
B. 达到平衡后,两种物质的浓度之比为2:1
C. 升高温度,平衡状态不改变
D. 若平衡后压强是开始的0.8倍,则转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
(1)写出实验室制备乙酸乙酯的化学方程式____________。
(2)乙醇、乙酸和浓硫酸的加入顺序是___________。
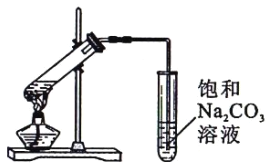
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下四个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
实验编号 | 试管I中的试剂 | 试管II中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL18mo/L浓硫酸 | 5.0 | |
B | 3mL乙醇、2mL乙酸 | 饱和碳酸钠溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_____mL和_____mol/L。
②分析实验_______(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________。
(4)饱和碳酸钠溶液的作用是溶解没有反应的乙醇,除去没有反应的乙酸和降低乙酸乙酯的溶解度。如何检验酯层中没有乙酸____________。
(5)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是_______________。
(6)分离碳酸钠溶液和乙酸乙酯的方法是_________,操作过程为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH3CHO(易溶于水,沸点为20.8 ℃)和CH3COOH(易溶于水,沸点为117.9 ℃)分离的最合适方法是
A. 蒸馏
B. 加入Na2CO3溶液后,通过萃取的方法分离
C. 加入烧碱溶液之后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D. 和Na反应后进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.材料的不断发展可以促进社会进步.
(1)钢铁是制造航母的主要材料,钢铁在潮湿空气中易发生________ 腐蚀,其负极反应是________ .请列举一种防止钢铁腐蚀的方法:________ .
(2)不锈钢丝与棉纤维可织成一种防辐射布料.这种布料属于________ (填字母).
a.合金材料 b.复合材料 c.陶瓷材料
(3)氮化硅是一种新型高温材料,可用于制造汽车发动机.请写出高纯硅和氮气在1300℃时反应制备氮化硅的化学方程式:________ .
II.我国新修订的《环境保护法》,使环境保护有了更严格的法律依据.
(1)往燃煤中加入________ (填化学式),可大大减少产物中的SO2 .
(2)漂白粉用于生活用水的杀菌消毒,漂白粉的有效成份是________ (填化学式).治理废水中的重金属污染物可用沉淀法.例如,往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为________ (填化学式)沉淀而除去.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)光导纤维的主要成分是________
(2)目前应用最多的太阳能电池的光电转化材料是________
(3)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为________
(4)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ________;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为________
(5)将表面已氧化的铝箔放入氢氧化钠溶液中,反应的离子方程式分别是________、________
(6)用铝箔包裹0.1mol金属钠,用针扎若干小孔后,放入水中,完全反应后,用排水法收集到标准状况下气体的体积________(填字母序号).
a.等于1.12L b.大于1.12L c.小于1.12L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O ,下列哪一种物质能使上述还原过程发生( )
A.KMnO4B.Na2CO3C.Cu2OD.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)写出下列变化的文字表达式并在括号内注明反应的基本类型。
①硫在氧气中燃烧________;
②在二氧化锰的催化下加热氯酸钾制氧气________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com