
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 配制1mol/LMgSO4溶液:将12.0gMgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 | |
| D. | 确定Na2CO3溶液中是否混有NaOH:取少量溶液滴加过量BaCl2溶液,过滤取滤液,在滤液中滴加酚酞,观察是否出现红色 |
分析 A.FeCl3和NaOH反应生成Fe(OH)3沉淀;
B.除杂时要除去杂质且不能引进新的杂质;
C.容量瓶只能配制一定物质的量浓度溶液,不能溶解或稀释药品;
D.向将碳酸根离子转化为沉淀,且生成中性物质,再向溶液中加入酚酞,根据酚酞颜色判断.
解答 解:A.FeCl3和NaOH反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体方法:沸水中滴加几滴FeCl3饱和溶液,继续加热至红褐色溶液即得到胶体,故A错误;
B.Fe和铜离子、铁离子都反应分别生成Cu、亚铁离子,除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤,然后向溶液中加入适量氯水,故B错误;
C.应该将硫酸镁在烧杯中溶解,然后将溶液冷却至室温后,再转移到容量瓶中配制溶液,故C错误;
D.向溶液中加入过量氯化钡溶液,碳酸钠和氯化钡反应生成碳酸钡沉淀同时生成中性物质氯化钠,氯化钡溶液呈中性,然后加入酚酞试液,如果酚酞变红,说明溶液呈碱性,则含有NaOH,否则不含NaOH,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、物质制备、物质检验、溶液配制等知识点,侧重考查分析判断及评价能力,明确实验原理、基本操作及物质性质是解本题关键,注意除杂时不能引进新的杂质且操作简便,易错选项是A.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:解答题
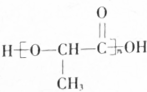 .合成N、F的路线如下:
.合成N、F的路线如下: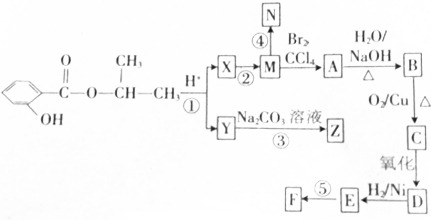
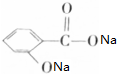 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇. →
→ +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
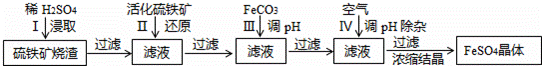
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com