
某有机物A的结构简式为:
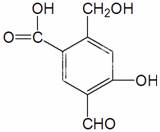
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是 。
(2)A与新制Cu(OH)2反应时, A与被还原的Cu(OH)2的物质的量之比是 。1molA最多能消耗 mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是 。
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
下图是Na2O2和CO2定性、定量实验的装置示意图。
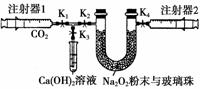
注射器1中抽取了100 mL CO2,U形管中装有适量小玻璃珠和约1.5 g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U形管中,注射器2活塞缓缓向外移动。回答下列问题:(本题不考虑注射器内壁的摩擦阻力)
(1)U形管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是________________________________________。
(2)U形管中可观察到的反应现象是___________________________________________
________________________________________________________________________。
(3)注射器1活塞推到底后,注射器2中收集到的气体大于50 mL,其原因除可能仍还含CO2外,还有一个重要原因是
________________________________________________________________________
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是
________________________________________________________________________。
(5)要证明反应产物之一为氧气,最为方便的实验方法是_______ _________________________________________________________________
_________________________________________________________________
________________________________________________________________________。
(6)本实验结束后固体产物板结,难以从U形管中取出,为了要证明固体产物中含有碳酸盐,实验时还需要从如下图所示仪器和试剂中选择________(填字母)。当装置和药品都安装完毕后,接下来的操作步骤是____________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于短周期元素,下列说法正确的是( )
A、若两元素原子序数相差8,则周期数一定相差1
B、两种简单离子不可能相差3个电子层
C、同族的两元素之间不可能形成化合物
D、最外层电子数相同的元素一定位于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯()的正确顺序是( )
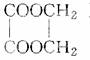 A.①⑤②③④ B.①②③④⑤
A.①⑤②③④ B.①②③④⑤
C.②③⑤①④ D.②③⑤①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| A | B | C | D | |
| 实验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
| 装置或仪器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
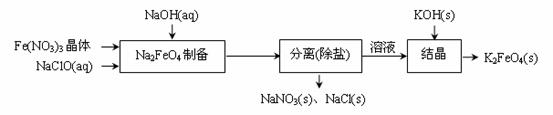
上述流程中制备Na2FeO4的化学方程式是 。
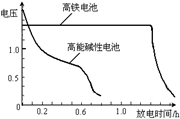
(4)高铁电池是正在研制中的可充电电池,右图为该电池和常用的高能
碱性电池的放电曲线,由此可得出的高铁电池的优点有 、
。
(5)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
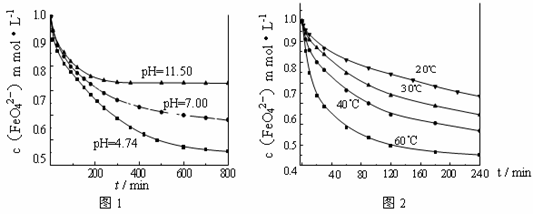
【实验2】将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为
1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42—+10 H2O 4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,新能源不断被应用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是________。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO+2Fe(NO3)3+10NaOH===2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4
Na2FeO4+2KOH===K2FeO4↓+2NaOH
主要的生产流程如下:

①写出反应①的离子方程式________________________________________________。
②流程图中“转化”(反应③)是在某低温下进行的,且此温度无NaOH析出,说明此温度下Ksp(K2FeO4)____Ksp(Na2FeO4)(填“>”、“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:__FeO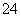 +__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
+__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
(4)FeO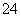 在水溶液中的存在形态如图所示:
在水溶液中的存在形态如图所示:
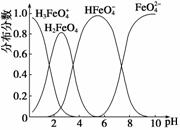
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO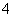 的分布分数的变化情况是________。
的分布分数的变化情况是________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,________转化为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法正确的是
A.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
B. 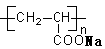 表示一种吸水性高分子树脂
表示一种吸水性高分子树脂
C.用于现代建筑的钢筋混凝土不属于复合材料
D.山东东营广饶县一男子收到网购物品后,因吸入氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构
简式为FCH2COOCH3,能与H2发生加成反应,也能被LiAlH4还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com