
ЁОЬтФПЁПюмдЊЫигЩгкЦфСМКУЕФЮяРэЛЏбЇаджЪЃЌБЛЙуЗКгІгУгкЩњВњЩњЛюжаЁЃРћгУКЌюмЗЯСЯ(КЌCoOЁЂCo2O3ЁЂН№ЪєAlЁЂLiЕШ)жЦШЁCoCl2ЁЄ6H2OЕФСїГЬЭМШчЭМЫљЪО

(1)аДГіВНжшIжажївЊЗДгІЕФЛЏбЇЗНГЬЪН_______ЁЃ
(2)ВНжшIIжаПЩгУбЮЫсДњЬцH2SO4гыH2O2ЕФЛьКЯвКЃЌЕЋШБЕуЪЧ___________ЁЃ
(3)ВНжшIIIЂйжаNa2CO3ШмвКЕФзїгУЪЧ__________ЁЃ
(4)ШєдкЪЕбщЪвьбЩе CaCO3ЃЌЫљашЙшЫсбЮВФжЪЕФвЧЦїГ§ОЦОЋЕЦКЭВЃСЇАєЭтЃЌЛЙга______(ЬювЧЦїУћГЦ)ЁЃ
(5)ВйзїЂйЕФВНжшЪЧ______ЁЂ________ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЃЯДЕгЙ§ГЬжаПЩвдгУввДМКЭЫЎЕФЛьКЯвКДњЬцЫЎЕФгХЕуЪЧ_______ЁЃ
(6)CoCl26H2OОЇЬхЪмШШвзЗжНтЃЌШЁ119gИУОЇЬхМгШШжСФГвЛЮТЖШЃЌЕУЕНCoCl2xH2OОЇЬх83gЃЌдђx=_____ЁЃ
ЁОД№АИЁП2Al+2NaOH+2H2O=2NaAlO2+3H2ЁќЁЂ2Li+2H2O=2LiOH+H2Ёќ бѕЛЏВњЮяЮЊТШЦјЛсЮлШОЛЗОГ ЕїНкpHГ§ШЅAl3+ЃЌ лсліЁЂФрШ§НЧ еєЗЂХЈЫѕ РфШДНсОЇ МѕЩйОЇЬхЕФШмНтЫ№ЪЇ 2
ЁОНтЮіЁП
КЌюмЗЯСЯ(КЌCoOЁЂCo2O3ЁЂЕЅжЪAlЁЂLiЕШ)МгШыЩеМюШмвКШмНтЃЌЕУЕНКЌТСШмвКЃЌЙ§ТЫГ§ШЅТЫвКЃЌЕУЕНКЌюмЕФТЫдќЃЌМгШыНўГіМСНўШЁюмЃЌЕУЕНКЌгаCo2+ЁЂAl3+ЁЂLi+ЕФШмвКЃЌМгШыЬМЫсФЦШмвКЕїНкpH4.5ЁЋ5ГСЕэAl3+ЃК2Al3++3CO32-+2H2O=2Al(OH)3Ё§+3CO2ЁќЃЌдйМгШыNaFГСЕэLi+ЃЌжЎКѓЙ§ТЫЃЌЯђТЫвКжаМгЬМЫсФЦЕїНкpHжС8ЁЋ8.5ЃЌГСЕэCo2+ЃЌЕУЕНCoCO3ЃЌзЦЩеCoCO3ЕУЕНCoOЃЌгУЯЁбЮЫсШмНтЕУЕНCoCl2ШмвКЃЌНЋШмвКдкHClЗеЮЇжаЃЌеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЕУЕНCoCl26H2OЃЌвдДЫНтД№ИУЬтЁЃ
(1)ВНжшIЮЊКЌюмЗЯСЯ(КЌCoOЁЂCo2O3ЁЂЕЅжЪAlЁЂLiЕШ)гыNaOHШмвКЛьКЯЃЌAlгыNaOHШмвКЗДгІЃЌLiгыЫЎЗДгІЃЌЗДгІЗжБ№ЮЊЃК2Al+2NaOH+2H2O=2NaAlO2+3H2ЁќЁЂ2Li+2H2O=2LiOH+H2ЁќЃЛ
(2)ВНжшЂђгІМгШыЛЙдМСЃЌНЋCo2O3ЛЙдЮЊCo2+ЃЌбЮЫсЮЊЛЙдадЫсЃЌЕЋЦфбѕЛЏВњЮяЮЊТШЦјЃЌТШЦјгаЖОЛсЮлШОЛЗОГЃЛ
(3)ВНжшЂѓжаЂйМгШыЬМЫсФЦШмвКЕїНкpH4.5ЁЋ5ПЩГ§ШЅAl3+ЃЌЗЂЩњЗДгІЃК2Al3++3CO32-+2H2O=2Al(OH)3Ё§+3CO2ЁќЃЛ
(4)дкЪЕбщЪвьбЩеCoCO3ЃЌЫљашЕФЙшЫсбЮжЪвЧЦїгаОЦОЋЕЦЁЂВЃСЇАєЁЂлсліЁЂФрШ§НЧЃЛ
(5)ВйзїЂйЪЧДгCoCl2ШмвКжаНсОЇCoCl26H2OЃЌОпЬхЮЊЃКНЋШмвКдкHClЗеЮЇжаЃЌеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЃЛЯДЕгЙ§ГЬжаПЩвдгУввДМКЭЫЎЕФЛьКЯвКДњЬцЫЎЃЌПЩвдМѕЩйОЇЬхЕФШмНтЫ№ЪЇЃЛ
(6)119gИУОЇЬхЕФЮяжЪЕФСПЮЊ![]() =0.5molЃЌКЌЫЎ3molЃЌМгШШКѓЪЇШЅНсОЇЫЎЕФжЪСПЮЊ119g-83g=36gЃЌn(H2O)=
=0.5molЃЌКЌЫЎ3molЃЌМгШШКѓЪЇШЅНсОЇЫЎЕФжЪСПЮЊ119g-83g=36gЃЌn(H2O)=![]() =2molЃЌдђ0.5molCoCl2xH2OКЌЫЎЮЊ3mol-2mol=1molЃЌЫљвдx=2ЁЃ
=2molЃЌдђ0.5molCoCl2xH2OКЌЫЎЮЊ3mol-2mol=1molЃЌЫљвдx=2ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ( )
A.18g АБЛљ(-N2H2)жаКЌгаЕФЕчзгЪ§ЮЊ 9 NA
B.32g Cu дкзуСПO2ЛђСђеєЦјжаЭъШЋЗДгІЪЇШЅЕФЕчзгЪ§ОљЮЊNA
C.гУЖшадЕчМЋЕчНт 100mL 0.1molЁЄL-1ЕФ CuSO4 ШмвКЃЌЕБвѕЁЂбєСНМЋВњЩњЯрЭЌЬѕМўЯТЕШЬхЛ§ЕФЦјЬхЪБЃЌЕчТЗжазЊвЦЕчзгЪ§ЮЊ 0.04 NA
D.ЕШЮяжЪЕФСПЕФFeBr2 КЭCl2 дкШмвКжаЕФЗДгІ Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЭМЪОгыЖдгІЕФа№ЪіЯрЗћКЯЕФЪЧ
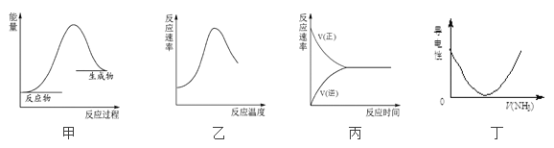
A. ЭММзБэЪОШМСЯШМЩеЗДгІЕФФмСПБфЛЏ
B. ЭМввБэЪОУИДпЛЏЗДгІЕФЗДгІЫйТЪЫцЗДгІЮТЖШЕФБфЛЏ
C. ЭМБћБэЪОПЩФцЗДгІДгМгШыЗДгІЮяПЊЪМНЈСЂЛЏбЇЦНКтЕФЙ§ГЬ
D. ЭМЖЁБэЪОНЋNH3ЭЈШыДзЫсШмвКЕФЙ§ГЬжаЃЌШмвКЕМЕчадЕФБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШАБЪЧТШЦјгіЕНАБЦјЗДгІЩњГЩЕФвЛРрЛЏКЯЮяЃЌЪЧГЃгУЕФвћгУЫЎЖўМЖЯћЖОМСЃЌжївЊАќРЈвЛТШАЗЁЂЖўТШАЗКЭШ§ТШАЗ(NH2C1ЁЂNHC12КЭNC13)ЃЌИБВњЮяЩйгкЦфЫќЫЎЯћЖОМСЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)ЂйвЛТШАЗ(NH2Cl)ЕФЕчзгЪНЮЊ__________ЁЃ
ЂкЙЄвЕЩЯПЩРћгУЗДгІCl2(g)+NH3(g)=NH2Cl(l)+HCl(g)жЦБИвЛТШАЗЃЌвбжЊВПЗжЛЏбЇМќЕФМќФмШчЯТБэЫљЪОЃЈМйЩшВЛЭЌЮяжЪжаЭЌжжЛЏбЇМќЕФСДФмЯрЭЌЃЉЃЌдђИУЗДгІЕФЁїH=______________ЁЃ
ЛЏбЇМќ | N-H | Cl-Cl | N-Cl | H-Cl |
МќФм(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
ЂлвЛТШАЗЪЧживЊЕФЫЎЯћЖОМСЃЌЦфдвђЪЧгЩгквЛТШАЗдкжаадЁЂЫсадЛЗОГжаЛсЗЂЩњЫЎНтЃЌЩњГЩОпгаЧПСвЩБОњзїгУЕФЮяжЪЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________________ЁЃ
(2)гУCl2КЭNH3ЗДгІжЦБИЖўТШАЗЕФЗНГЬЪНЮЊ2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)ЃЌЯђШнЛ§ОљЮЊ1 LЕФМзЁЂввСНИіКуЮТЃЈЗДгІЮТЖШЗжБ№ЮЊ400ЁцЁЂTЁц)ШнЦїжаЗжБ№МгШы2 mol C12КЭ2 mol NH3ЃЌВтЕУИїШнЦїжаn(Cl2)ЫцЗДгІЪБМфtЕФБфЛЏЧщПіШчЯТБэЫљЪОЃК
NHCl2(g)+2HCl(g)ЃЌЯђШнЛ§ОљЮЊ1 LЕФМзЁЂввСНИіКуЮТЃЈЗДгІЮТЖШЗжБ№ЮЊ400ЁцЁЂTЁц)ШнЦїжаЗжБ№МгШы2 mol C12КЭ2 mol NH3ЃЌВтЕУИїШнЦїжаn(Cl2)ЫцЗДгІЪБМфtЕФБфЛЏЧщПіШчЯТБэЫљЪОЃК
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(МзШнЦї)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (ввШнЦїЃЉ/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
ЂйМзШнЦїжаЃЌ0ЁЋ40 minФкгУNH3ЕФХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪv(NH3)=______________ЁЃ
ЂкИУЗДгІЕФЁїH________0(ЬюЁА>ЁБЛђЁА<ЁБ) ЃЌРэгЩЪЧ____________________ЁЃ
ЂлЖдИУЗДгІЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ______________(ЬюбЁЯюзжФИЃЉЁЃ
A.ШєШнЦїФкЦјЬхУмЖШВЛБфЃЌдђБэУїЗДгІДяЕНЦНКтзДЬЌ
B.ШєШнЦїФкC12КЭNH3ЮяжЪЕФСПжЎБШВЛБфЃЌдђБэУїЗДгІДяЕНЦНКтзДЬЌ
C.ЗДгІДяЕНЦНКтКѓЃЌЦфЫћЬѕМўВЛБфЃЌдкдШнЦїжаГфШывЛЖЈСПКЄЦјЃЌCl2ЕФзЊЛЏТЪдіДѓ
D.ЗДгІДяЕНЦНКтКѓЃЌЦфЫћЬѕМўВЛБфЃЌМгШывЛЖЈСПЕФNHCl2ЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
(3)дкКуЮТЬѕМўЯТЃЌ2molCl2КЭ1molNH3ЗЂЩњЗДгІ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)ЃЌВтЕУЦНКтЪБCl
NHCl2(l)+2HCl(g)ЃЌВтЕУЦНКтЪБCl
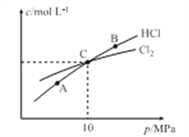
ЂйAЁЂBЁЂCШ§ЕужаCl2зЊЛЏТЪзюИпЕФЪЧ______Еу(ЬюЁАAЁБЁАBЁБЛђЁАCЁБ)ЁЃ
ЂкМЦЫуCЕуЪБИУЗДгІЕФбЙЧПЦНКтГЃЪ§Kp(C)=_______(KpЪЧЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЌЗжбЙ=змбЙЁСЮяжЪЕФСПЗжЪ§)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯуРМЫиЪЧживЊЕФЯуСЯжЎвЛЃЌЫќПЩгЩЖЁЯугЭЗгОЖрВНЗДгІКЯГЩЃЌгаЙиетСНжжЛЏКЯЮяЕФЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ

A.ГЃЮТЯТЃЌ1molЖЁЯугЭЗгжЛФмгы1molBr2ЗДгІ
B.ЖЁЯугЭЗгВЛФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІ
C.1molЯуРМЫизюЖрФмгы3molH2ЗЂЩњМгГЩЗДгІ
D.гУЫсадKMnO4ШмвКВЛФмМјБ№ЖЁЯугЭЗгКЭЯуРМЫи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУШчЭМЕчНтзАжУНЋЮэіВжаЕФSO2ЁЂNOзЊЛЏЮЊ(NH4)2SO4ЃЌгУЦфзїЮЊвЛжжгХСМЕФЕЊЗЪЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
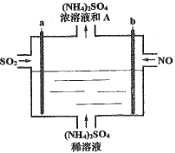
A.aгыЕчдДИКМЋЯрСЌЃЌЗЂЩњЛЙдЗДгІ
B.УПДІРэlmolNOПЩвдЩњГЩ2molA
C.ЭЈЕчКѓбєМЋИННќШмвКЕФpHдіДѓ
D.РэТлЩЯНЋSO2гыNOвдЬхЛ§БШ2:5ЭЈШызАжУПЩГЙЕззЊЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЙиЯТСаЫФИіГЃгУЕчЛЏбЇзАжУЕФа№ЪіжаЃЌе§ШЗЕФЪЧЃЈ ЃЉ
|
|
|
|
ЭМЂёМюадаПУЬЕчГи | ЭМЂђЧІ-СђЫсаюЕчГи | ЭМЂѓЕчНтОЋСЖЭ | ЭМЂєвјаПХІПлЕчГи |
A.ЭМЂёЫљЪОЕчГижаЃЌMnO2ЕФзїгУЪЧДпЛЏМС
B.ЭМIIЫљЪОЕчГиЗХЕчЙ§ГЬжаЃЌСђЫсХЈЖШВЛЖЯдіДѓ
C.ЭМIIIЫљЪОзАжУЙЄзїЙ§ГЬжаЃЌЕчНтжЪШмвКжаCu2+ХЈЖШЪМжеВЛБф
D.ЭМIVЫљЪОЕчГижаЃЌAg2OЪЧбѕЛЏМСЃЌЕчГиЙЄзїЙ§ГЬжаЛЙдЮЊAg
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊЬсЩ§ЕчГибЛЗаЇТЪКЭЮШЖЈадЃЌПЦбЇМвНќЦкРћгУШ§ЮЌЖрПзКЃУрзДZnЃЈ3D-ZnЃЉПЩвдИпаЇГСЛ§ZnOЕФЬиЕуЃЌЩшМЦСЫВЩгУЧПМюадЕчНтжЪЕФ3D-Zn-NiOOHЖўДЮЕчГиЃЌНсЙЙШчЭМЫљЪОЁЃЕчГиЗДгІЮЊZn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)ЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
ZnO(s)+2Ni(OH)2(s)ЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
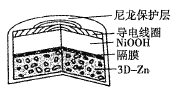
A.Ш§ЮЌЖрПзКЃУрзДZnОпгаНЯИпЕФБэУцЛ§ЃЌЫљГСЛ§ЕФZnOЗжЩЂЖШИп
B.ЗХЕчЪБе§МЋЗДгІЮЊNiOOH(s)+H2O(l)+e-=Ni(OH)2(s)+OH-(aq)
C.ЗХЕчЪБИКМЋЗДгІЮЊZn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)
D.ЗХЕчЙ§ГЬжаOH-ЭЈЙ§ИєФЄДгИКМЋЧјвЦЯђе§МЋЧј
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇЕчдДдкШеГЃЩњЛюКЭИпПЦММСьгђжаЖМгаЙуЗКгІгУЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A.  Zn2+ЯђCuЕчМЋЗНЯђвЦЖЏЃЌCuЕчМЋИННќШмвКжаH+ХЈЖШдіМг
Zn2+ЯђCuЕчМЋЗНЯђвЦЖЏЃЌCuЕчМЋИННќШмвКжаH+ХЈЖШдіМг
B. 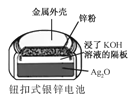 е§МЋЕФЕчМЋЗДгІЪНЮЊAg2OЃЋ2eЃЋH2O2AgЃЋ2OH
е§МЋЕФЕчМЋЗДгІЪНЮЊAg2OЃЋ2eЃЋH2O2AgЃЋ2OH
C.  аПЭВзїИКМЋЃЌЗЂЩњбѕЛЏЗДгІЃЌаПЭВЛсБфБЁ
аПЭВзїИКМЋЃЌЗЂЩњбѕЛЏЗДгІЃЌаПЭВЛсБфБЁ
D. 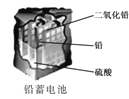 ЪЙгУвЛЖЮЪБМфКѓЃЌЕчНтжЪШмвКЕФЫсадМѕШѕЃЌЕМЕчФмСІЯТНЕ
ЪЙгУвЛЖЮЪБМфКѓЃЌЕчНтжЪШмвКЕФЫсадМѕШѕЃЌЕМЕчФмСІЯТНЕ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com