
分析 (1)铜与浓硝酸反应生成二氧化氮和水、硝酸铜;
(2)随着反应进行,硝酸浓度降低变为稀硝酸,稀硝酸与铜反应生成硝酸铜和一氧化氮、水;
(3)硝酸根离子在酸性环境下具有强的氧化性,能够继续氧化铜;
(4)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其相对分子质量.
解答 解:(1)铜与浓硝酸反应生成二氧化氮和水、硝酸铜,化学方程式:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)随着反应进行,硝酸浓度降低变为稀硝酸,稀硝酸与铜反应生成硝酸铜和一氧化氮、水,方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(3)硝酸根离子在酸性环境下具有强的氧化性,能够继续氧化铜,
故答案为:H2SO4提供H+,NO3-继续与Cu发生反应;
(4)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;
Cu跟一定量的浓硝酸反应首先生成二氧化氮,随着反应的进行,硝酸的浓度变稀,反应生成一氧化氮,依据氧化还原反应的规律可知铜失去的电子总数等于硝酸得到的电子总数,设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
依据氮原子个数守恒的:x+y=$\frac{5.6L}{22.4L/mol}$=0.25mol;
依据得失电子相等得:$\frac{12.8g}{64g/mol}$×2=x+3y,
解得:x=0.175mol,y=0.075mol,
气体的平均摩尔质量=$\frac{0.175mol×46g/mol+0.075mol×30g/mol}{0.25mol}$=41.2g/mol;
所以其平均相对分子质量为41.2;
故答案为:0.65mol;41.2.
点评 本题考查了硝酸的性质及氧化还原反应计算,难度中等,注意利用氮原子个数守恒和得失电子数守恒思想计算.


科目:高中化学 来源: 题型:选择题
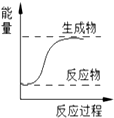
| A. | 金属钠与水的反应 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl (固体)混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
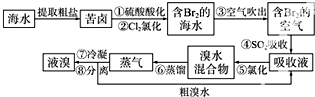
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
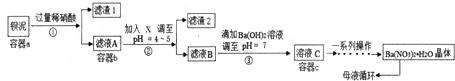
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
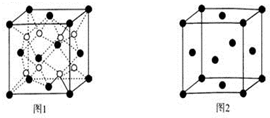
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有三种含氧官能团 | |
| B. | 可发生取代、加成及氧化反应 | |
| C. | 在水溶液中羟基和羧基均能电离出氢离子 | |
| D. | 与足量的钠反应在标况下能产生44.8L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com