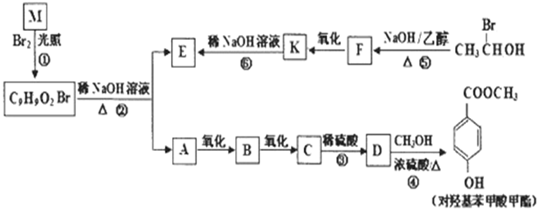
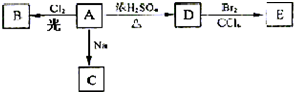
解答:
解:(1)检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,所以检验装置气密性的方法是:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好,
故答案为:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)乙二酸晶体加热分解生成CO
2和CO装置A中的①导出气体,此实验验证是反应产物中含有CO
2和CO(装置不能重复使用),应首先验证二氧化碳①→⑤→④,然后除去二氧化碳④→⑥→⑦,验证二氧化碳的方法是:把气体通入澄清的石灰水,澄清石灰水变浑浊,则含有二氧化碳;然后除去二氧化碳,二氧化碳与氢氧化钠反应除去,剩余为一氧化碳,验证一氧化碳存在⑦→②→③,一氧化碳与氧化铜反应生成二氧化碳,然后通入澄清石灰水,澄清石灰水变浑浊,则含有一氧化碳,
故答案为:⑤④⑥⑦②③;
(3)一氧化碳与氧化铜反应CuO+CO
Cu+CO
2生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,
故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(4)一氧化碳有毒,一氧化碳具有可燃性,尾气处理的方法是点燃,2CO+O
22CO
2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),
故答案为:在导管③后放置一个燃着的酒精灯(或用气囊收集);
(5)12.6克H
2C
2O
4?2H
2O的物质的量为n=
=
=0.1mol,乙二酸晶体加热分解H
2C
2O
4?2H
2O
3H
2O+CO
2↑+CO↑,则生成的一氧化碳、二氧化碳的物质的量分别为:0.1mol、0.1mol,反应产生的气体全部排出,并与吸收液充分反应,C装置中n(Ca(OH)
2)=cv=0.05mol/L×0.1L=0.005mol,
CO
2+Ca(OH)
2=CaCO
3↓+H
2O、CO
2+H
2O+CaCO
3=Ca(HCO
3)
2,即2CO
2+Ca(OH)
2=Ca(HCO
3)
2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cv=1mol/L×0.1L=0.1mol,
CO
2 +2NaOH=Na
2CO
3+H
2O CO
2 +H
2O+Na
2CO
3 =2NaHCO
30.05mol 0.1mol 0.05mol 0.09mol-0.05mol 0.04mol 0.08mol
所以D中溶质及对应的物质的量是0.01mol Na
2CO
3和0.08mol NaHCO
3,
故答案为:0.01mol Na
2CO
3和0.08mol NaHCO
3.

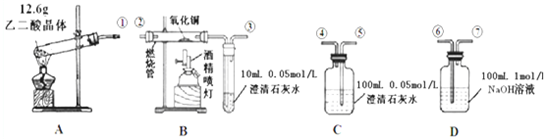



 有图中所示转化关系(无机产物略):
有图中所示转化关系(无机产物略):