

分析 【方案l】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量.
(1)分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置B是干燥氨气,选择碱石灰,若去掉装置B,测定氨气含量会增大,AlN的含量会增大,计算装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
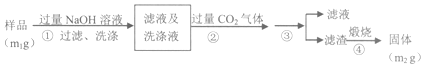
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
解答 解:【方案1】(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;把装置中残留的氨气全部赶入C装置;
(3)装置B是干燥氨气,选择碱石灰,选②,若去掉装置B,测定氨气含量会增大,导致AlN的含量测定结果偏高,装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
故答案为:②;偏高;C装置出口处连接一个干燥装置;
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=$\frac{{m}_{2}g}{102g/mol}$=$\frac{{m}_{2}}{102}$mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=$\frac{{m}_{2}}{102}$mol×2=$\frac{{m}_{2}}{51}$mol,A1N的纯度=$\frac{\frac{{m}_{2}}{51}mol×41g/mol}{{m}_{1}g}$×100%=$\frac{41{m}_{2}}{51{m}_{1}}$×100%,
故答案为:过滤、洗涤;$\frac{41{m}_{2}}{51{m}_{1}}$×100%.
点评 本题考查了物质性质的探究实验设计和氮化铝含量的测定,实验基本操作和物质性质的掌握是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 D.
D.
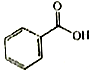 F.
F. 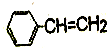 G.
G.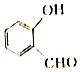
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2 | |
| B. | 铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 | |
| C. | 化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色 | |
| D. | 密度为1.1 g•cm-3与密度为1.2 g•cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g•cm-3与1.2 g•cm-3之间; Na-K合金的熔点应介于Na和K熔点之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、CO32- | B. | Na+、NO3-、Ac-、K+ | ||
| C. | Al3+、Na+、Cl-、SO42- | D. | Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物都是非金属氧化物 | |
| B. | 乙醇和二甲醚分子式相同,结构不同,互为同素异形体 | |
| C. | 丁达尔效应可用于区别溶液与胶体 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com