
| A. | 晶体熔点的高低: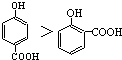 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.根据分子间氢键增大熔点,分子内氢键降低熔点判断;
B、都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;
C、金属单质熔沸点与其金属键成正比,金属键与半径成反比,与电荷成正比;
D、离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强.
解答 解:A.因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低: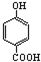 >
>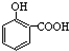 ,故A正确;
,故A正确;
B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C-C<C-Si<Si-Si,所以硬度:金刚石>碳化硅>晶体硅,故B正确;
C、Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C错误;
D、晶格能与离子半径成反比,与电荷成正比,离子半径,F-<Cl-<Br-<I-,则晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选C.
点评 本题考查晶体熔沸点高低判断,侧重考查晶体类型判断及晶体熔沸点高低影响因素,注意晶格能、金属键与离子半径、离子所带电荷关系,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:填空题
 ②:
②: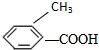
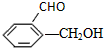 ④
④ ⑤
⑤
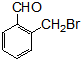 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验含碘盐中的碘元素 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 除去CuSO4溶液中的Fe2(SO4)3,加入足量CuO粉末,充分搅拌过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
如图所示为CH4燃料电池的装置(A、B为多孔碳棒):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 果糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
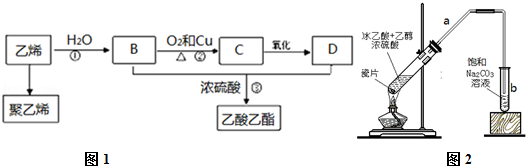
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com