
【题目】在三个容积均为2L的密闭容器中发生反应:2HI(g)H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)实验1和实验2中使用了催化剂的实验是(填“1”或“2”);
(2)实验1中,0l0min内生成H2的平均反应速率为molL﹣1min﹣1;
(3)实验3的反应达到化学反应限度时,HI(g)转化率为 .
【答案】
(1)2
(2)0.005
(3)80%
【解析】解:(1.)实验1和实验2比较,温度、起始物质的量均相同,实验2达到平衡的时间少,则实验2中使用了催化剂,所以答案是:2;
(2.)v(HI)= ![]() =
= ![]() =0.01mol/(L.min),由速率之比等于化学计量数之比可知H2的平均反应速率为0.01mol/(L.min)×
=0.01mol/(L.min),由速率之比等于化学计量数之比可知H2的平均反应速率为0.01mol/(L.min)× ![]() =0.005mol/(L.min),所以答案是:0.005;
=0.005mol/(L.min),所以答案是:0.005;
(3.)由表格数据可知,HI起始的物质的量为1.0mol,平衡时的物质的量为0.2mol,则HI(g)转化率为 ![]() ×100%=80%,所以答案是:80%.
×100%=80%,所以答案是:80%.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4FeOH)3(s)能自发进行,则△H<0
C. NH4Al(SO4)2溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3·H2O
D. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯丙胺(H2C=CHCH2—NH2)是合成化学及药物化学中非常重要的基本单元。下列有关烯丙胺的说法正确的是( )
A.有三种同分异构体B.所有原子可能在同一平面内
C.具有两性D.能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国劳伦斯·利弗莫尔国家实验室2006年成功合成了118号超重元素,并观察到其存在了不到1毫秒时间。该元素符号为:Uuo,质量数为293,以下叙述不正确的是
A. 该元素原子核外含有118个电子,核内有175个中子
B. 该元素属于第七周期
C. 该元素一定是一种金属元素
D. 该元素位于零族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )
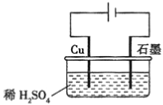
A. 电解过程中,铜极上有H2生成
B. 电解初期,主反应方程式为:2H2O=H2↑+O2↑
C. 整个电解过程中,H+的浓度不断增大
D. 电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。

②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列说法正确的是( )
A. 在标准状况下,1 mol水的体积是22.4 L
B. 1 mol H2所占的体积约为22.4 L
C. 在标准状况下, 阿伏加德罗常数个分子所占的体积约为22.4 L
D. 在标准状况下,1 mol NH3和CO混合气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列名词与环境污染无关的是( )
①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病
A.①②
B.⑦⑧
C.⑥⑦⑧
D.②⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com