
| A. | 向淀粉水解液中滴加碘水,检验淀粉是否已经水解 | |
| B. | 利用多次滴加Na2SO4溶液能够提纯蛋白质 | |
| C. | 加新制Cu(OH)2悬浊液加热,可检验糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振荡后,静置分液 |
分析 A.滴加碘水,只能检验淀粉,不能检验葡萄糖;
B.Na2SO4溶液能使蛋白质发生盐析;
C.葡萄糖在碱性溶液中与氢氧化铜反应生成砖红色沉淀;
D.苯酚与NaOH反应后,与甲苯分层.
解答 解:A.滴加碘水,只能检验淀粉,不能检验葡萄糖,则淀粉可能没有水解、或部分水解,故A错误;
B.Na2SO4溶液能使蛋白质发生盐析,为可逆过程,则利用多次滴加Na2SO4溶液能够提纯蛋白质,故B正确;
C.加新制Cu(OH)2悬浊液加热,观察是否生成砖红色沉淀,可检验糖尿病人尿液中的葡萄糖,故C正确;
D.苯酚与NaOH反应后,与甲苯分层,则加入NaOH溶液振荡后,静置分液可除杂,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、物质检验、混合物分离提纯等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成2mol SO2的同时,消耗2molSO3 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1molSO2 | |
| D. | 混合气体的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
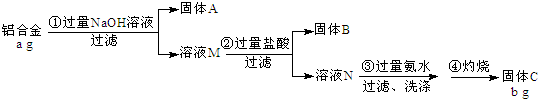
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
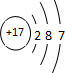 ,元素B在周期表中的位置2周期ⅥA族.
,元素B在周期表中的位置2周期ⅥA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com