
����Ŀ������β�����ŷŵ�NOx��CO��Ⱦ������������β��ϵͳ��װ�ô�ת����������Ч����NOx��CO���ŷš�
��֪:��2CO(g)+O2(g)![]() 2CO2(g) ��H=-akJ/mol
2CO2(g) ��H=-akJ/mol
��N2(g)+O2(g)![]() 2NO(g) ��H=+bkJ/mol
2NO(g) ��H=+bkJ/mol
��2NO(g)+O2(g)![]() 2NO2(g) ��H=-ckJ/mol
2NO2(g) ��H=-ckJ/mol
�ش���������:
��1��CO��ȼ����Ϊ_________��
��2��CO��NO2��ԭΪ���ʵ��Ȼ�ѧ����ʽΪ_________��
��3��Ϊ��ģ�ⷴӦ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�ڴ�ת�����ڵĹ������������һ���������÷�Ӧ�ں����ܱ������н��У��ô�������ò�ͬʱ��NO��CO��Ũ�����±�:
N2(g)+2CO2(g)�ڴ�ת�����ڵĹ������������һ���������÷�Ӧ�ں����ܱ������н��У��ô�������ò�ͬʱ��NO��CO��Ũ�����±�:
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
��ǰ2s�ڵ�ƽ����Ӧ����v(N2)=_________,���¶��£��÷�Ӧ��ƽ�ⳣ��K=_________��
����˵��������Ӧ�ﵽƽ��״̬����________��
A.2n(CO2)=n(N2) B.��������ƽ����Է�����������
C.�����ܶȲ��� D.����������ѹǿ����
�۵�NO��COŨ�����ʱ����ϵ��NO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
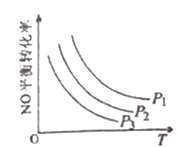
��NO��ƽ��ת�������¶����߶���С��ԭ����______________��ͼ��ѹǿ(P1��P
���𰸡� (a/2)kJ/mol 2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ��H=-(2a+b-c)KJ/mol 1.875��10-4mol��L-1��s-1 5000(��5000L/mol) BD �÷�Ӧ����Ӧ�����������¶ȣ�ƽ�������ƶ���NO��ƽ��ת���ʼ�С P1>P2>P3 ����ӦΪ�����С�ķ�Ӧ����ѹƽ�������ƶ���NO�ĺ�ת��������
N2(g)+4CO2(g) ��H=-(2a+b-c)KJ/mol 1.875��10-4mol��L-1��s-1 5000(��5000L/mol) BD �÷�Ӧ����Ӧ�����������¶ȣ�ƽ�������ƶ���NO��ƽ��ת���ʼ�С P1>P2>P3 ����ӦΪ�����С�ķ�Ӧ����ѹƽ�������ƶ���NO�ĺ�ת��������
���������������������ͨ������β����NOx��COת���N2��CO2��Ӧԭ����̽�֣���Ҫ�����Ȼ�ѧ����ʽ��д����ѧ��Ӧ���ʺ�ƽ�ⳣ���ļ��㡢��ѧƽ��״̬���жϡ���ѧƽ���ƶ��Ȼ���֪ʶ�����鿼����ȼ���ȸ�������⼰ͼ���ʶ����������ѧƽ��֪ʶ���ۺ�����������
��������1��ȼ������ָ298K��1.01��105Paʱ��1mol��ȼ����ȫȼ�������ȶ��������ͷŵ���������˸��ݷ�Ӧ�٣�COȼ����Ϊa/2 kJ/mol����ȷ�𰸣�a/2 kJ/mol����2����Ӧԭ����2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)������ԭ��Ӧ�١�2-��-�ڵõ�������H=--(2a+b-c)KJ/mol����ȷ�𰸣�2NO2(g)+4CO(g)
N2(g)+4CO2(g)������ԭ��Ӧ�١�2-��-�ڵõ�������H=--(2a+b-c)KJ/mol����ȷ�𰸣�2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ��H=-(2a+b-c)KJ/mol����3����
N2(g)+4CO2(g) ��H=-(2a+b-c)KJ/mol����3����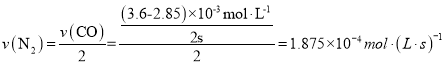 ��4s����ϵ��CO��NOŨ�Ⱦ����ֲ��䣬��Ӧ�ﵽƽ��״̬����ʱ�μӷ�Ӧ��NOΪ��10.0-1.00����10-4mol��L-1=9��10-4mol��L-1���μӷ�Ӧ��CO��3.6-2.7����10-3mol��L-1=9��10-4mol��L-1������CO 2Ũ��Ϊ9��10-4mol��L-1��N 2Ũ��Ϊ4.5��10-4mol��L-1������
��4s����ϵ��CO��NOŨ�Ⱦ����ֲ��䣬��Ӧ�ﵽƽ��״̬����ʱ�μӷ�Ӧ��NOΪ��10.0-1.00����10-4mol��L-1=9��10-4mol��L-1���μӷ�Ӧ��CO��3.6-2.7����10-3mol��L-1=9��10-4mol��L-1������CO 2Ũ��Ϊ9��10-4mol��L-1��N 2Ũ��Ϊ4.5��10-4mol��L-1������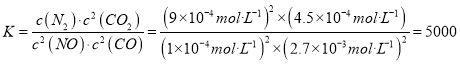 ����ȷ�𰸣�1.875��10-4mol��L-1��s-1��5000���ڿ��淴Ӧ�ﵽƽ��ʱ�����淴Ӧ������ȣ���ϵ�и����ʺ������ֲ��䡣A�������ķ�Ӧ�������ܷ�Ӧ���ʣ��Ҷ�������Ӧ���ʣ�A����B�����ڷ�Ӧ�������������ʵ�����С�������������������䣬���Է�Ӧ����������л���������У�M=m/n����ı䣬���Bһ������ƽ��״̬��B��ȷ��C������������䣬�����������䣬�������۷�Ӧ��ν��У�������ܶȶ����ı䣬���C�����жϷ�Ӧ�Ƿ���ƽ��״̬��C����D���������ʱ����Ӧ�������ʱ������٣�ѹǿ��С����֮ѹǿ��������������ѹǿ����ʱ���÷�Ӧһ�����ڻ�ѧƽ��״̬��D��ȷ����ȷ����BD��������ѡ��ijһѹǿ����ͼ��֪��������������ʱ�������¶�����NOƽ��ת���ʼ�С���������¶�ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ�����������������¶���ͬʱ����ͼ��֪ѹǿ��P1��P2��P3�仯ʱ��NOƽ��ת���ʼ�С����ƽ�������ƶ����ɷ�Ӧ����ϵ���ɵã�ƽ�������ƶ���Ӧ����ѹǿ��С������P1>P2>P3����ȷ�𰸣��÷�Ӧ����Ӧ���ȣ������¶ȣ�ƽ�������ƶ���NO��ƽ��ת���ʼ�С ��P1>P2>P3 ������ӦΪ�����С�ķ�Ӧ����ѹƽ�������ƶ���NO�ĺ�ת����������
����ȷ�𰸣�1.875��10-4mol��L-1��s-1��5000���ڿ��淴Ӧ�ﵽƽ��ʱ�����淴Ӧ������ȣ���ϵ�и����ʺ������ֲ��䡣A�������ķ�Ӧ�������ܷ�Ӧ���ʣ��Ҷ�������Ӧ���ʣ�A����B�����ڷ�Ӧ�������������ʵ�����С�������������������䣬���Է�Ӧ����������л���������У�M=m/n����ı䣬���Bһ������ƽ��״̬��B��ȷ��C������������䣬�����������䣬�������۷�Ӧ��ν��У�������ܶȶ����ı䣬���C�����жϷ�Ӧ�Ƿ���ƽ��״̬��C����D���������ʱ����Ӧ�������ʱ������٣�ѹǿ��С����֮ѹǿ��������������ѹǿ����ʱ���÷�Ӧһ�����ڻ�ѧƽ��״̬��D��ȷ����ȷ����BD��������ѡ��ijһѹǿ����ͼ��֪��������������ʱ�������¶�����NOƽ��ת���ʼ�С���������¶�ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ�����������������¶���ͬʱ����ͼ��֪ѹǿ��P1��P2��P3�仯ʱ��NOƽ��ת���ʼ�С����ƽ�������ƶ����ɷ�Ӧ����ϵ���ɵã�ƽ�������ƶ���Ӧ����ѹǿ��С������P1>P2>P3����ȷ�𰸣��÷�Ӧ����Ӧ���ȣ������¶ȣ�ƽ�������ƶ���NO��ƽ��ת���ʼ�С ��P1>P2>P3 ������ӦΪ�����С�ķ�Ӧ����ѹƽ�������ƶ���NO�ĺ�ת����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ�������ձ��ײ������ܳ��ֵ�����ǣ�������
A.��ͭ����B.������ͭC.������ͭD.������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϸ���ڻ��������������ȷ����
A. �����������������Ҫ�е���
B. ������ֲ��ϸ���ڵ���Ҫ�ɷ�
C. DNA��һ��������Ŵ�����
D. Ⱦɫ����Ҫ��RNA�͵��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���仯������������������Ӧ�ù㷺��
��.��1��þ��Ԫ�����ڱ��е�λ��Ϊ___________
��2��þ��̼���ﳣ������MgC2��Mg2C3���֣��ɷֱ���ˮ�ⷴӦ������Ȳ�ͱ���ϩ��д��MgC2ˮ�ⷴӦ�ķ���ʽΪ_________;Mg2C3�ĵ���ʽΪ_________.
��3����Mg���Ƴ���þһ����������ȼ�ϵ�أ���װ��ʾ��ͼ����ͼ��ʾ���õ�ط�Ӧ�����ӷ���ʽΪ____________.

��.�����ȼҵ����[��Mg(OH)2��������CaCO3��MnCO3��FeCO3��Al(OH)3��SiO2��]����MgSO4��7H2O�Ĺ�����������ͼ��ʾ��

��4�����ʱ��FeCO3�����ᷴӦ�Ļ�ѧ����ʽΪ_____________��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_____(����ĸ)��
a.����÷������ȡ b.��С�������Ȳ���ֽ��� c.�ʵ��ӳ���ȡʱ��
��5������ʱ������������Һ��MnSO4����ΪMnO2�����ӳ�ʽΪ______________;����2ΪMnO2��_____________��___________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ����2.0L�����ܱ������г���2mol SO2��1mol O2 �� ������Ӧ�� 2SO2��g��+O2��g��2SO3��g��������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | t1 | t2 | t3 | t4 |
n��SO3��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
����˵����ȷ���ǣ�������
A.��Ӧ��ǰt1 s ��ƽ������v��O2��= ![]() molL��1s��1
molL��1s��1
B.���������������䣬���ѹ����1.0L��ƽ�ⳣ��������
C.��ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �ﵽƽ��ʱ��SO3��ת���ʴ���10%
D.�����¶Ȳ��䣬����������ٳ���2mol SO2��1mol O2 �� ��Ӧ�ﵽ��ƽ��ʱ ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:N2O4(g)![]() 2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. ��ƿ��������������ٱ仯
B. ��ƿ���������ɫ���ٱ仯
C. ��ƿ�������ѹǿ���ٱ仯
D. N2O4������������NO2����������֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ���ǣ�������
A.pH=5��H2S��Һ�У�c��H+��=c��HS����=1��10��5molL��1
B.pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1
C.pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c��Na+��+c��H+��=c��OH����+c��HC2O4����
D.pH��ͬ�Ģ�CH3COONa��NaHCO3��NaClO������Һ��c��Na+�����٣��ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪34Se��35Brλ��ͬһ���ڣ�����Ԫ�������ڱ��е�λ�ã�����˵����ȷ����
A. ��ԭ�ԣ�Cl����Br�� B. ���ԣ�H2SeO4��HBrO4��HClO4
C. ԭ�Ӱ뾶��Cl��Br��Se D. ��̬�⻯����ȶ��ԣ�H2S��H2Se
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol��L-1������� 0.1000mol��L-1Na2CO3��Һ25.00mL����pH��������û����Һ��pH�仯������ͼ������˵����ȷ����
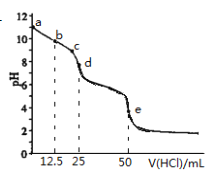
A. c��d�㷢������Ҫ���ӷ�Ӧ��HCO3-+H+=H2O+CO2
B. ��b��ʱ��c(CO32-)>c(HCO3-)>c(OH-)
C. ��d��ʱ�� c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. ��e��ʱ�� c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com