(1)把一小块金属钠放入盛水(滴有酚酞)的烧杯中,可以观察到金属钠浮在水面上,迅速熔化成闪亮的小球,发出嘶嘶的声音,并四处游动,直到消失.烧杯中的溶液变成红色.通过分析这些实验现象,可以得出金属钠的具有如下的性质(写三条即可):
①______;②______;③______;
(2)若把金属钠放到硫酸铜溶液中,看不到红色固体生成,能观察到有蓝色和黑色沉淀生成,请写出发生的所有反应的化学方程式(是离子反应的写离子方程式):______ CuO+H2O
【答案】
分析:钠与水反应放出的热能使本身熔化成闪亮的小球,说明熔点低,浮在水面,说明密度比水小,加入酚酞的液体变红,说明生成了碱性物质,能与硫酸铜反应生成蓝色沉淀,说明生成了氢氧化铜沉淀,有黑色沉淀,说明反应放热,生成的氢氧化铜分解生成氧化铜.
解答:解:(1)根据实验所描述:切一小块钠放入盛水的烧杯中,观察到钠能与水剧烈反应,并放出热量,本身熔化成闪亮的小球,浮在水面上.可推断钠的物理性质有:固态、密度小于水、熔点低等,与水反应后溶液呈红色,说明反应后溶液呈碱性,生成NaOH,
故答案为:密度小于水;熔点低;与水反应生成NaOH(或其它合理答案);
(2)钠与水剧烈反应:2Na+2H
2O=2Na
++2OH
-+H
2↑,
氢氧化钠能与硫酸铜反应生成氢氧化铜沉淀和硫酸钠:Cu
2++2OH
-═Cu(OH)
2↓,
反应放热,生成的氢氧化铜分解生成氧化铜:Cu(OH)
2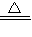
CuO+H
2O,
故答案为:2Na+2H
2O=2Na
++2OH
-+H
2↑,Cu
2++2OH
-═Cu(OH)
2↓,Cu(OH)
2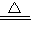
CuO+H
2O.
点评:本题考查钠的化学性质,题目难度不大,根据反应的实验现象推断可能具有的性质,并学会根据实验现象书写有关的方程式.

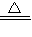 CuO+H2O,
CuO+H2O,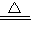 CuO+H2O.
CuO+H2O.

 备战中考寒假系列答案
备战中考寒假系列答案