
| A. | 苯和植物油 | B. | 乙酸乙酯与饱和碳酸钠溶液 | ||
| C. | 甘油和水 | D. | 苯和液溴 |
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的氯化铵固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 垃圾是放错地方的资源,应分类回收利用 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
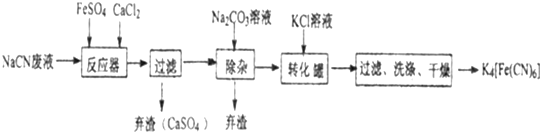
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com