
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
分析 增大压强,上述平衡将向正反应方向移动,结果混合气体的总质量减小,混合气体的总物质的量也减小,混合气体的物质的量每减少2mol,就有1molCO(NH2)2生成,气体的总质量就减少60g,设原平衡时混合气体总质量为mg,总物质的量为n mol,增大压强平衡移动后气体物质的量减小2xmol,则新平衡时平均相对分子质量为$\frac{m-60x}{n-2x}$,原平衡时相对分子质量为$\frac{m}{n}$,若$\frac{m-60x}{n-2x}$=$\frac{m}{n}$,可得$\frac{m}{n}$=30,因此,若原平衡混合气体的$\overline{Mr}$>30,平衡正向移动后$\overline{Mr}$增大;若原平衡混合气体的$\overline{Mr}$=30,平衡正向移动后$\overline{Mr}$不变;若原平衡混合气体的$\overline{Mr}$<30,平衡正向移动后$\overline{Mr}$减小,计算原混合气体的平均相对分子质量判断.
解答 解:增大压强,上述平衡将向正反应方向移动,结果混合气体的总质量减小,混合气体的总物质的量也减小,混合气体的物质的量每减少2mol,就有1molCO(NH2)2生成,气体的总质量就减少60g,设原平衡时混合气体总质量为mg,总物质的量为n mol,增大压强平衡移动后气体物质的量减小2xmol,则新平衡时平均相对分子质量为$\frac{m-60x}{n-2x}$,原平衡时相对分子质量为$\frac{m}{n}$,若$\frac{m-60x}{n-2x}$=$\frac{m}{n}$,可得$\frac{m}{n}$=30,因此,若原平衡混合气体的$\overline{Mr}$>30,平衡正向移动后$\overline{Mr}$增大;若原平衡混合气体的$\overline{Mr}$=30,平衡正向移动后$\overline{Mr}$不变;若原平衡混合气体的$\overline{Mr}$<30,平衡正向移动后$\overline{Mr}$减小,
开始时原混合气体的平均相对分子质量为$\frac{14×17+13×44}{14+13}$=30,因此增大压强,平衡正向移动后气体的平均相对分子质量不变,始终为30,
故选:B.
点评 本题考查化学平衡计算,题目粗看平均相对分子质量如何变化似乎无法判断,关键仔细分析气体物质的量减小与质量减小关系,再结合相对分子质量表达式利用作差解答,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液具有相同的性质:均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 只有胶状的物质如胶水、果冻类的才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 铜 | 石墨 | CuSO4 |
| B | 铜 | 铁 | CuSO4 |
| C | 铁 | 铜 | Fe(NO3)3 |
| D | 铁 | 铜 | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
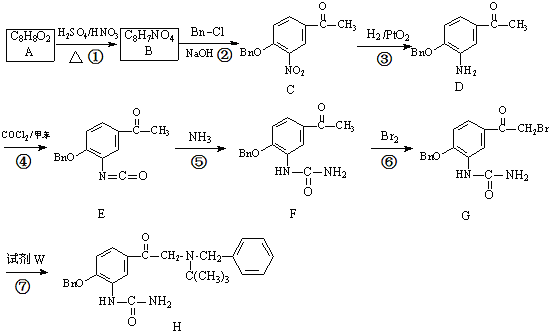
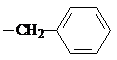 试剂W
试剂W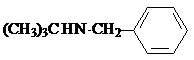 .
.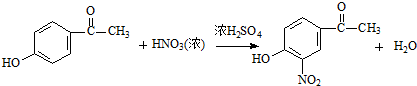 .
.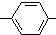 CH2
CH2 N=C=O生成高聚物的结构简式
N=C=O生成高聚物的结构简式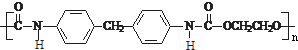 .
.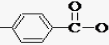 -CH2CH2N(C2H5)2(无机试剂任用)
-CH2CH2N(C2H5)2(无机试剂任用) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
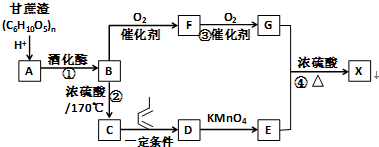
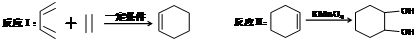
 ,F官能团的名称为醛基,
,F官能团的名称为醛基,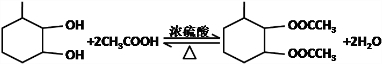 .
. Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色
Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色 的合成路线为
的合成路线为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com