
| A. |  | B. | 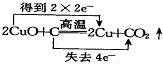 | ||
| C. |  | D. |  |
分析 氧化还原反应中,化合价降低值=化合价升高值=转移电子数,根据氧化还原反应规律知识来判断.
解答 解:A、反应中化合价降低值(得到电子数)=化合价升高值(失电子数目)=转移电子数=2,即转移2mol电子,故A错误;
B、反应中化合价降低值(得到电子数)=化合价升高值(失电子数目)=转移电子数=4,即转移4mol电子,故B正确;
C、反应中化合价降低值(得到电子数)=化合价升高值(失电子数目)=转移电子数=12,即转移12mol电子,故C错误;
D、反应中化合价降低值(得到电子数)=化合价升高值(失电子数目)=转移电子数=2,化合价爱降低元素是得到电子,升高元素是失去电子,故D错误;
故选B.
点评 本题考查学生氧化还原反应中的基本概念以及电子转移的基本知识,属于基本知识的考查,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

| A. | B F | B. | A E | C. | B E | D. | A D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硝酸 | CaCO3 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
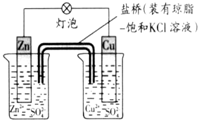
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)>c(Cl-)>c ( NO3-) | B. | c(Ca2+)>c ( NO3-)>c (Cl-) | ||
| C. | c(NO3-)>c ( Ca2+ )>c ( Cl-) | D. | c ( Cl-)>c(Ca2+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com