
分析 (1)依据碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物分析,K、Na、Ba、Ca的阳离子与氢氧根形成的是强碱;
(2)能导电的电解质处于熔融状态下;
(3)离子方程式为H++OH-═H2O,是强酸强碱反应生成溶于水的盐和水分析判断;
(4)一种单质与一种化合物反应生成另外一种单质与另外一种化合物,属于置换反应;
(5)氢氧化钡溶于水形成的溶液中通入少量的二氧化碳气体生成碳酸钡;
(6)依据氧化还原反应电子守恒和原子守恒计算分析产物中氮元素化合价,得到X化学式,元素化合价升高的做还原剂,元素化合价降低的为氧化剂,结合化学方程式计算得到;依据化学方程式中电子转移计算得到电子转移数.
解答 解:(1)氨水和氢氧化钙固体均是碱,前者是弱碱,后者是强碱,故答案为:⑧;
(2)熔融状态下能导电的化合物,属于电解质,故答案为:⑨;
(3)硝酸与氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水,可以用离子方程式H++OH-═H2O表示,对应反应为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:⑥⑧;
(4)氢气还原氧化铜为置换反应,故答案为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(5)在⑧Ba(OH)2固体的溶液中通入少量的④CO2,反应生成碳酸钡,反应的离子方程式Ba2++2OH-+CO2═BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2═BaCO3↓+H2O;
(6)8Al+30HNO3=8Al(NO3)3+3X+9H2O,设氮元素化合价降低为x,依据氧化还原反应电子守恒,8×3=3(5-x)得到x=-3,依据原子守恒则生成的产物NH4NO3;8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O,8molAl做还原剂与3molHNO3做氧化剂的物质的量之比是=8:3,216gAl反应转移电子物质的量为24mol,当有8.1g Al发生反应时,转移电子的物质的量=$\frac{8.1g×24mol}{216g}$=0.9mol,
故答案为:NH4NO3;8:3;0.9NA.
点评 本题考查了电解质、非电解质的判断,离子方程式书写、物质的量的计算,明确相关概念、离子方程式的意义是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
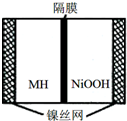 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<a<0 | B. | b>a>0 | C. | a=b<0 | D. | a=b>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
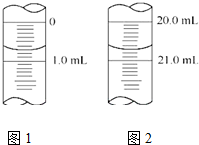 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氢化物比Y的氢化物的沸点更高 | |
| B. | X与Z组成的化合物溶于水呈碱性 | |
| C. | 只有Y元素存在同素异形体 | |
| D. | X、Y、Z、R形成简单离子的半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲可用于检验乙烯生成 | |
| B. | 装置乙可用于收集和吸收氨气 | |
| C. | 装置丙可用于出去CO2中混有的SO2气体 | |
| D. | 装置丁可分离碘的CCl4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com